Титриметрический анализ
Задача №1:
Рассчитайте процентное содержание поваренной соли в пищевом продукте, если на титрование водной вытяжки, полученной при настаивании 100 мл воды с 2,72 г продукта, израсходовано 7,50 мл 0,051 Н AgNO3.
Задача №2:
Для титрования навески образца гидроксида натрия (NaOH) массой 0,1281 г, содержащего некоторое количество карбоната натрия (Na2CO3) в качестве примеси, было израсходовано при использовании фенолфталеина в качестве индикатора 23,90 мл 0,1295 М НСl. Рассчитайте массовую долю карбоната натрия в данном образце, если для титрования такой же его навески с метиловым оранжевым было израсходовано 24,40 мл этого же раствора НСl.
Задача №3:
На титрование 100 мл смеси соляной и фосфорной кислоты 0,1 н. раствором гидроксида натрия с использованием в качестве индикатора метилового оранжевого (рТ = 4,0) потребовалось 200 мл раствора титранта. На титрование, c использованием в качестве индикатора фенолфталеина (рТ = 9,0), потребовалось 300 мл раствора титранта. Определить молярные концентрации соляной и фосфорной кислот в смеси.
Задача №4:
Определить массовую долю двуокиси марганца, содержащейся в пробе массой 0,261 г, которую вначале обработали 100 мл 0,0500 н. раствора сульфата железа (II) (избыток) для полного протекания реакции, а остаток оттитровали 40,0 мл 0,0500 н. раствора K2Cr2O7.
Задача №5:
Определить молярную концентрацию рабочего раствора ЭДТА (комплексона III), если на титрование навески металлического цинка массой 0,0131 г, растворенного предварительно в кислоте, затратили 18,46 мл этого раствора.
Задача №6:
Вычислить массовую долю (%) СаСO3 и МgCO3 в известняке, если после растворения 1,000 г его получили 100,0 мл раствора, на титрование 20,00 мл которого для определения суммы Са и Mg с эриохром черным Т израсходовали 19,25 мл 0,05140 М ЭДТА, а на титрование Са с мурексидом в отдельной пробе затратили 6,25 мл того же раствора ЭДТА.
Задача №7:
К 20,00 мл раствора, содержащего алюминий (Al3+), добавили 50,00 мл 0,0108 М ЭДТА при рН = 5 и раствор прокипятили для образования комплекса AlЭДТА-. Избыток ЭДТА оттитровали 16,75 мл 0,020 М раствором CuSO4 концентрацию ионов алюминия в растворе (моль/л).
Задача №8:
Взяли навеску образца едкого натра массой 0,9184 г, частично превратившегося под влиянием СO2 воздуха в соду, и растворили в мерной колбе на 250,0 см3. На титрование 25,00 см3 раствора в присутствии фенолфталеина израсходовали 20,70 см3 раствора HCl с C = 0,1042 моль/дм3, а в присутствии метилового оранжевого — 21,48 см3 этого же раствора HCl. Вычислите процентное содержание NaOH и Na2CO3 в образце.
Задача №9:
Ампулу, содержащую 1,200 г раствора HNO3, разбили в растворе NaOH объемом 30,0 cм3 и концентрации 0,800 моль/дм3. Остаток щелочи, не вступившей в реакцию, был оттитрован 20,0 cм3 0,500 моль/дм3 раствора HCl. Вычислите массовую долю HNO3 в растворе.
Задача №10:
Для определения азота в муке навеску ее в 0,8880 г обработали концентрированной серной кислотой, переведя азот в аммонийную соль (NH4HSO4). Аммиак из соли был отогнан действием щелочи в раствор, содержащий 20,0 см3 НСl (THCl/NH3 = 0,0030 г/см3), а избыток кислоты оттитровали 5,5 см3 раствора NaOH с С = 0,1962 моль/дм3. Рассчитайте процентное содержание азота в муке.
Задача №11:
Для определения свободного Р2О5 в суперфосфате навеску последнего массой 10,0 г взболтали с водой, отфильтровали в мерную колбу вместимостью 500,0 см3, промывая фильтр, довели раствор в мерной колбе до метки и перемешали. На титрование 50,0 см3 полученного раствора Н3РО4 (до NaH2PO4) затратили 16,51 см3 0,1015 моль/дм3 раствора гидроксида натрия. Вычислите массовую долю Р2О5 в суперфосфате.
Задача №12:
Чистое неизвестное органическое основание оттитровали стандартным раствором соляной кислоты. Зная, что масса образца составила 0,5650 г и что на титрование затратили 22,2 см3 0,100 моль/дм3 раствора HCl, вычислите эквивалентную массу основания.
Задача №13:
Для стандартизации раствора тиосульфата натрия навеску KBrO3 массой 0,1510 г растворили в разбавленной НСl, добавили избыток KI и выделившийся I2 оттитровали, затратив 39,7 см3 раствора Na2S2O3. Рассчитайте нормальность раствора тиосульфата натрия.
Задача №14:
Образец мышьяк содержащего препарата массой 8,1300 г разложили мокрым способом с помощью HNO3 и H2SO4. В остатке мышьяк восстановили до As3+ гидразином. После удаления избытка восстановителя на титрование ионов As3+ в слабой щелочной cреде израсходовали 23,7 см3 раствора I2 с С = 0,0485 моль/дм3. Рассчитайте процентное содержание As2O3 в образце.
Задача №15:
Пробу сточной воды, содержащей ионы никеля, объемом 1,0 дм3 выпарили досуха. После отделения мешающих компонентов получили осадок диметилглиоксимата никеля. Промытый осадок растворили, добавили 10,0 см3 0,010 моль/дм3 раствора трилона Б, на титрование избытка которого затратили 3,05 см3 0,010 моль/дм3 стандартного раствора соли магния. Вычислите массовую концентрацию ионов никеля (мг/дм3) в сточной воде.
Задача №16:
Аликвоту 50,0 см3 пробы жесткой воды титруют 15,0 см3 0,010 моль/дм3 раствора ЭДТА в присутствии индикатора арсеназо. Другую такую же аликвотную часть пробы воды сильно подщелачивают гидроксидом натрия, что приводит к выпадению осадка. На титрование раствора в присутствии индикатора кальцеина израсходовано 10,0 см3 0,0120 моль/дм3 раствора ЭДТА. Определите:
- молярные концентрации ионов кальция и магния в этой пробе;
- общую жесткость воды (в ммоль-экв/дм3).
Задача №17:
Для определения содержания этилмеркаптана в смеси (MC2H5SH = 62,13 г/моль) пробу массой 1,6500 г встряхивали с 50,0 см3 раствора I2 с С = 0,1190 моль/дм3 в плотно закрытой колбе. При этом протекала реакция по уравнению:
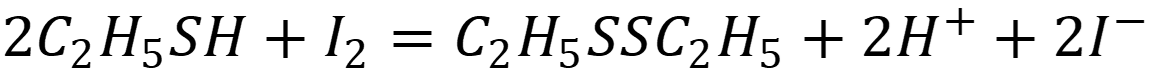
На титрование избытка йода затратили 16,7 см3 раствора тиосульфата натрия с С = 0,1320 моль/дм3. Рассчитайте процентное содержание этилмеркаптана в пробе.
Задача №18:
Для анализа отобрали 20,0 см3 сточной воды, содержащей соединения железа, окислили их до Fe3+ и осадили в виде гидроксида. Промытый осадок растворили в НСl и оттитровали 4,05 см3 0,0505 моль/дм3 раствора комплексона III. Вычислите концентрацию железа (мг/см3) в сточной воде.

