Выбор буферной системы для поддержания pH
Буферный раствор - смесь компонентов протолитической пары слабых протолитов. При добавлении небольших количеств сильной кислоты или основания, а так же при разбавлении рН таких растворов почти не меняется.
Для таких систем верно равенство:
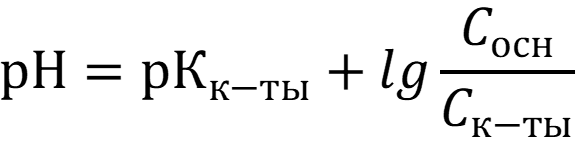
Расчёт буферной ёмкости - т.е. способности раствора сохранять постоянную концентрацию определённых ионов, в данном случае H+.
Буферная ёмкость по кислоте:

Буферная ёмкость по основанию:

Буферная ёмкость:
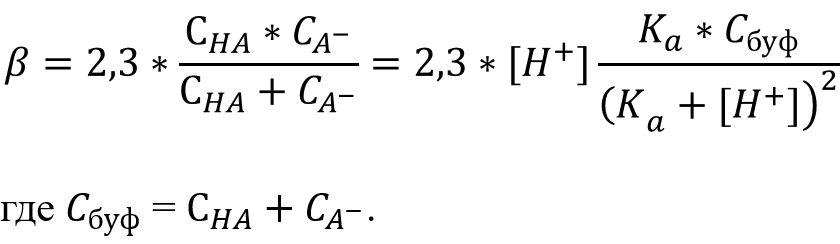
Задача №1:
Какой состав карбонатного буферного раствора способен обеспечить постоянство pH 10,00 ± 0,05 при добавлении к 200,0 мл этого раствора 0,0050 моль сильного основания или кислоты? Для H2CO3 pKa,1 = 6,35; pKa,2 = 10,32.
Дано:
Vбуф
= 200,0 мл
pKa,1 (H2CO3) =
6,35
pKa,2 (H2CO3) =
10,32
nк-ты/осн = 0,0050 моль
pH = 10,00
ΔpH = ±
0,05
Состав буферного раствора - ?
Решение:
Рассчитаем буферную ёмкость необходимую для поддержания pH в указанных пределах:
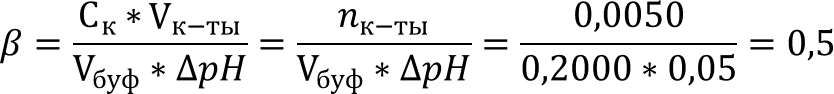
Учитывая что при pH = 10,00 буферный раствор имеет состав HCO3- + CO32-, рассчитаем Сбуф:
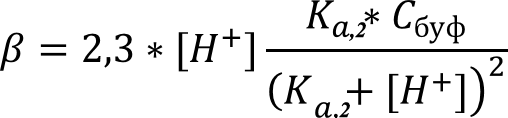
Выразим Сбуф
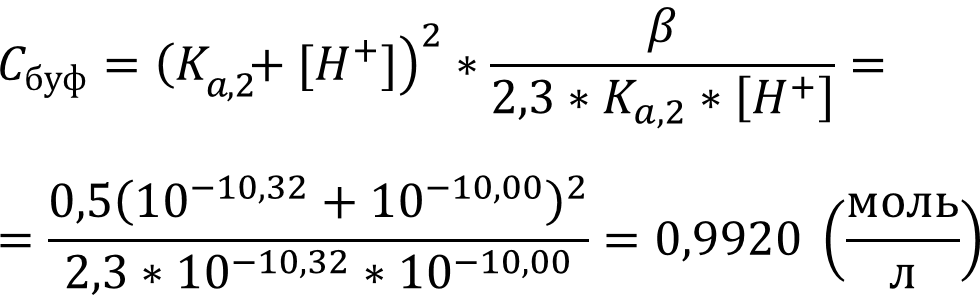
Обратим внимание при расчёте, что нам даны показатели величин, для пересчёта необходимо возвести 10 в степень минус показатель величины!
Воспользуемся формулой для вычисления pH буферного раствора:
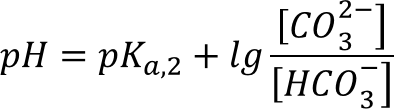
Выразив из уравнения отношение концентраций кислоты и основания:
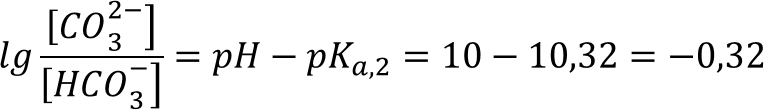
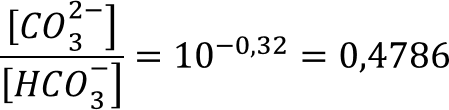
Рассчитаем из выражения концентрацию бикарбонат-иона, приняв во внимание, что Cбуф = CCO32- + CHCO3- и приняв за X - [HCO3-].
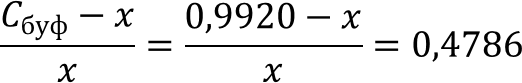
По итогу расчётов x = 0,6709 M = CHCO3-
CCO32- = Cбуф - CHCO3- = 0,9920 - 0,6709 = 0,3211 M
Ответ: CHCO3- = 0,6709 M; CCO32- = 0,3211 M.
Задача №2:
Сколько граммов твёрдого гидрооксида натрия необходимо добавить к 100,0 мл 0,1000 М раствора NH4Cl, чтобы полученный раствор имел pH = 9,75. Чему равна буферная ёмкость этого раствора?
Дано:
Vбуф
= 100,0 мл
СNH4Cl = 0,1000 М
pH = 9,75
β;
mNaOH - ?
Решение:
Выпишем из справочника необходимые данные:
pKa,NH3 = 9,25
MNaOH = 39,992 г/моль
При решении изменение объёма не учитываем, тогда:
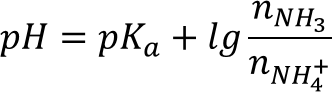
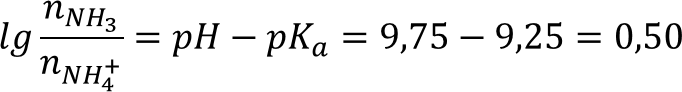
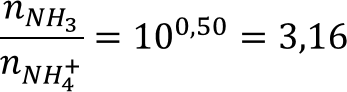
Согласно уравнению хлорид аммония реагирует с щёлочью, как 1 к 1:
NH4+ + OH- = NH3 + H2O
Приняв количество основания за Х и с учётом расхода кислоты-NH4+ на реакцию:
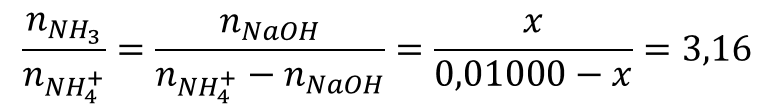
x = 0,007596 моль = nNaOH
mNaOH = nNaOH * MNaOH = 0,007596 * 39,992 = 0,3038 г
Далее рассчитаем буферную ёмкость полученного раствора по формуле:
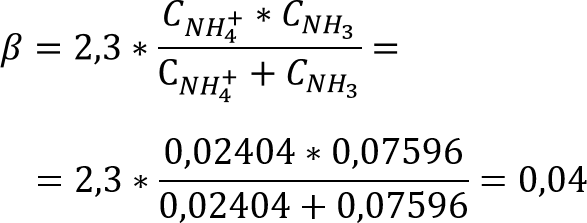
где
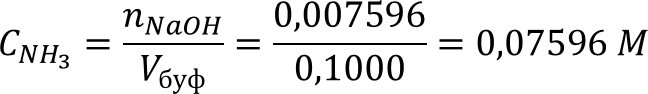
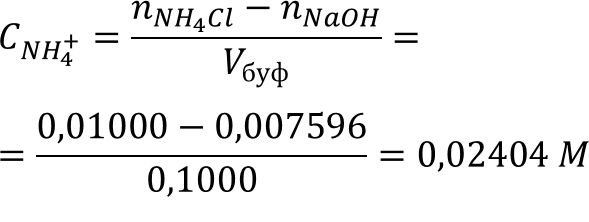
Ответ: mNaOH = 0,3038 г; β = 0,04

