Кондуктометрия
Метод основан на измерении электропроводности растворов:
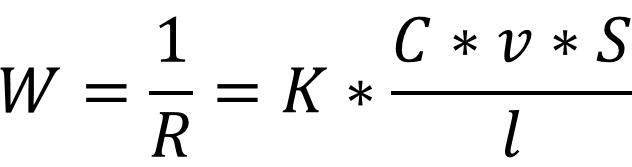
где K - коэффициент пропорциональности; С - концентрация раствора; v - подвижность ионов; S - площадь электродов; l - расстояние между электродами.
При расчётах используют понятие "удельная электропроводность" - это электропроводность раствора, заключённого между плоскими электродами площадью 1 см2 каждый, находящихся друг от друга на расстоянии 1 см:
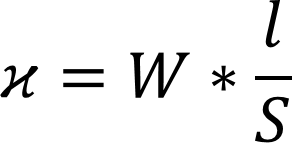
Также удобно использовать "эквивалентную электропроводность" - проводимость 1 моль эквивалента вещества при стандартных условиях:
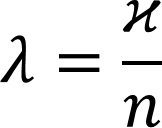
где n - количество эквивалентов в растворе.
Особенности кондуктометрических методов анализа:
-
без больших затруднений проводить определения не только в прозрачных, но и в окрашенных и мутных растворах, а также в присутствии окислителей и восстановителей, ограничивающих применение органических индикаторов в других методах;
-
осуществлять определения разнообразных неорганических и органических индивидуальных соединений;
-
анализировать не только сравнительно концентрированные растворы, но и разбавленные до 10-4 М;
-
проводить исследование не только водных, но и неводных и смешанных водно-органических растворов;
-
сравнительно легко осуществлять автоматизацию процессов титрования;
-
широко использовать разнообразные типы реакций (нейтрализации, осаждения, комплексообразования, окисления — восстановления, присоединения, замещения, конденсации, омыления и т. п.), сопровождающихся изменением электропроводности анализируемых растворов;
-
во многих случаях избежать предварительного отделения примесей, обычно мешающих определению другими методами;
-
просто и точно определять конечную точку титрования по пересечению двух прямых и соответственно вычислять точку эквивалентности;
-
использовать переменный ток низкой частоты и постоянный ток;
-
производить дифференцированное титрование смесей электролитов, что невозможно осуществить другими методами.
Кондуктометрию так же используют для нахождения растворимости труднорастворимых веществ и степени диссоциации слабых электролитов. Отношение эквивалентной электропроводности раствора слабого электролита к эквивалентной электропроводности этого электролита при бесконечном разбавлении равна степени диссоциации этого электролита:
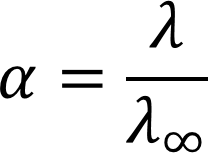
Несмотря на высокую точность и простоту прямой кондуктометрический метод анализа не нашёл широкого применения в практике аналитических лабораторий. Это связано с тем, что метод не является специфичным, т.к. измеряемая электрическая проводимость является суммой электрических проводимостей всех ионов, присутствующих в растворе. Поэтому даже малейшие примеси изменяют значение электрической проводимости и искажают результаты. Однако метод широко применяется для целей автоматизации контроля в различных непрерывных химических производствах.
В прямой кондуктометрии используют два способа:
- Градуировочного графика - определение концентрации по зависимости от удельной электропроводности.
- Расчётный метод:
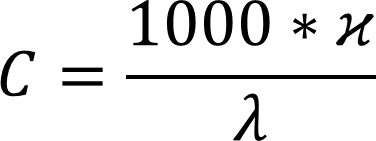
Так как удельная электропроводность сильно зависит от многих факторов, в частности от температуры (изменение на 1o увеличивает погрешность определения на 1-2 %), то большее применение в лаборатории нашло кондуктометрическое титрование.
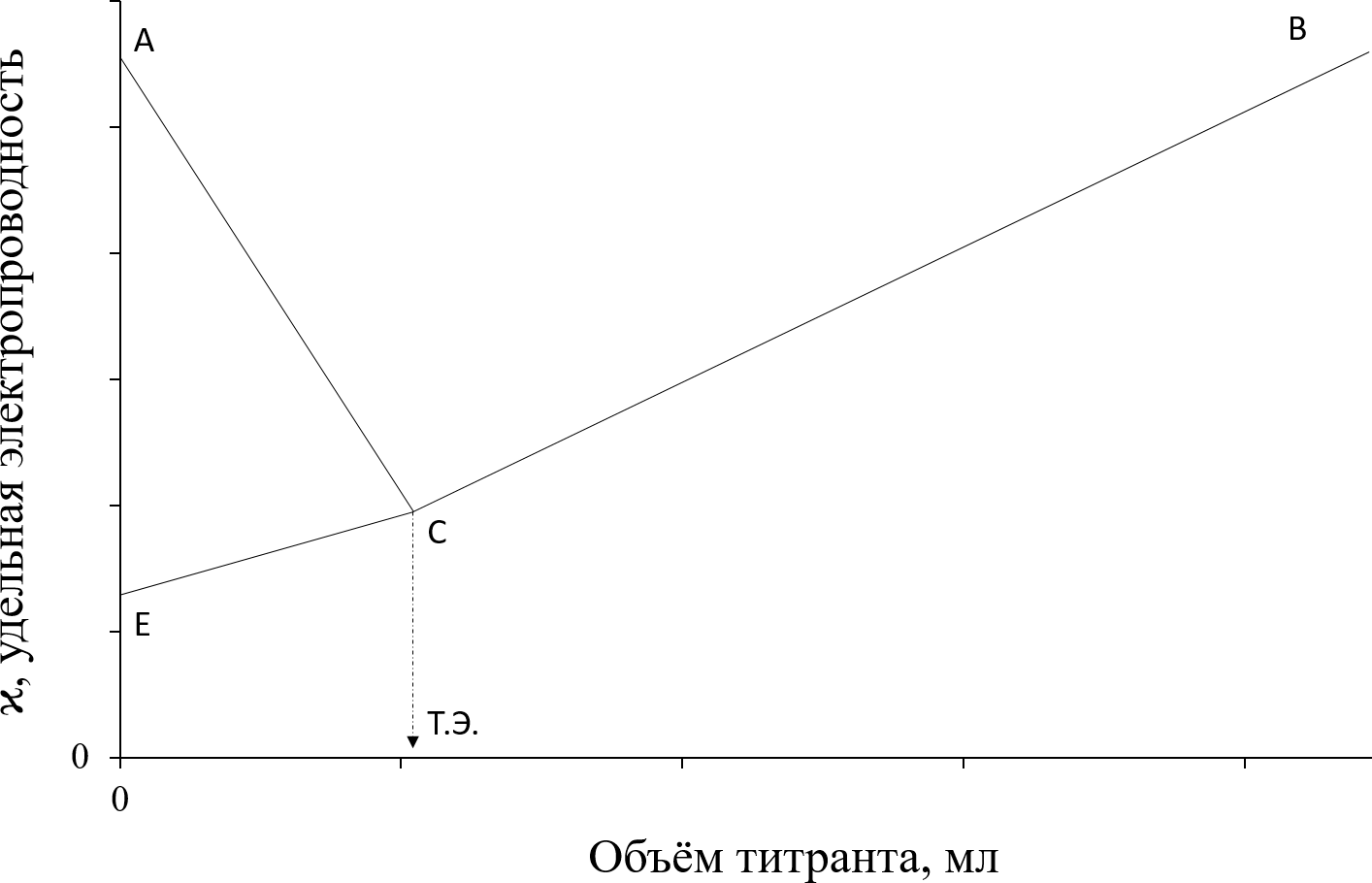
ACB
- сильная кислота титруется щёлочью
ECB - слабая кислота титруется
щёлочью
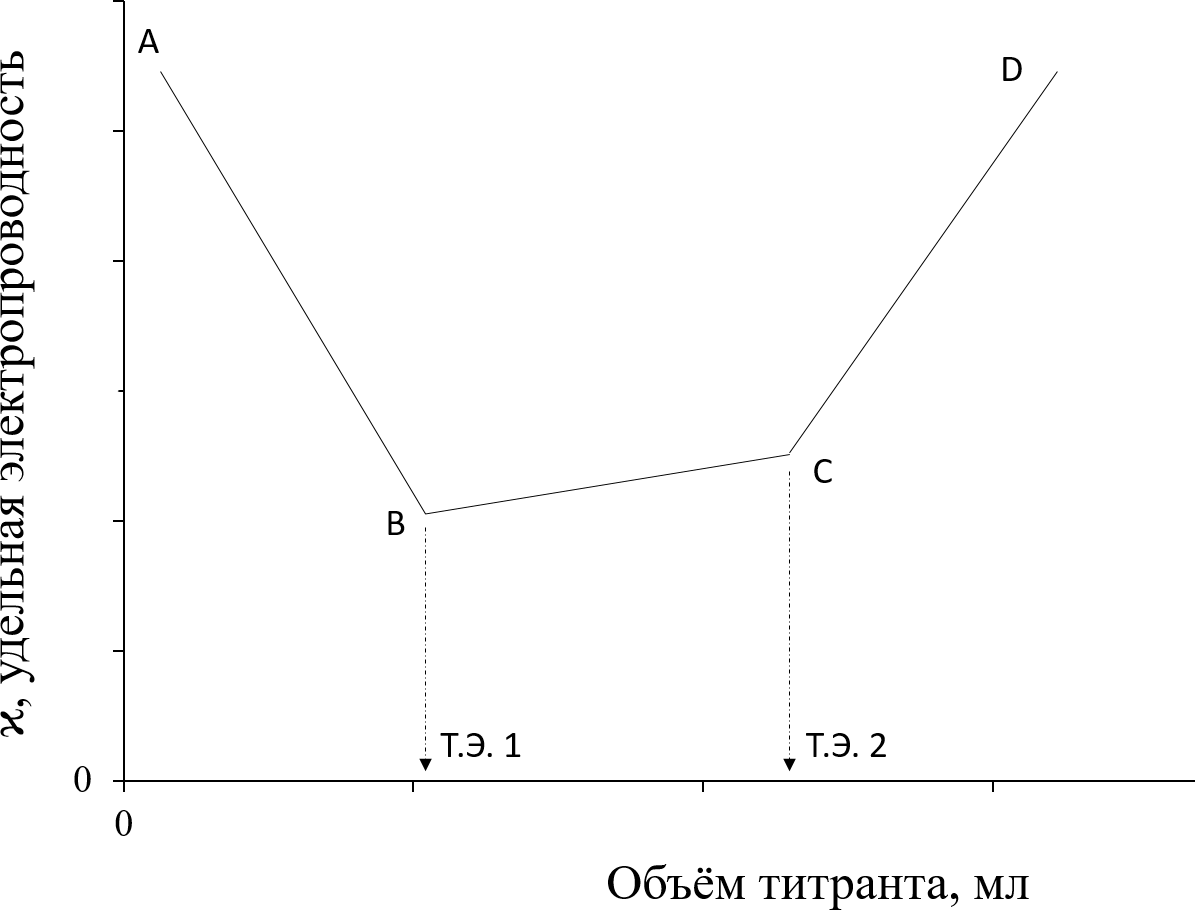
Титрование смеси кислот или двухосновных кислот

AB
- титрование солей, подвергающихся гидролизу
CD - титрование солей при
отсутствии гидролиза
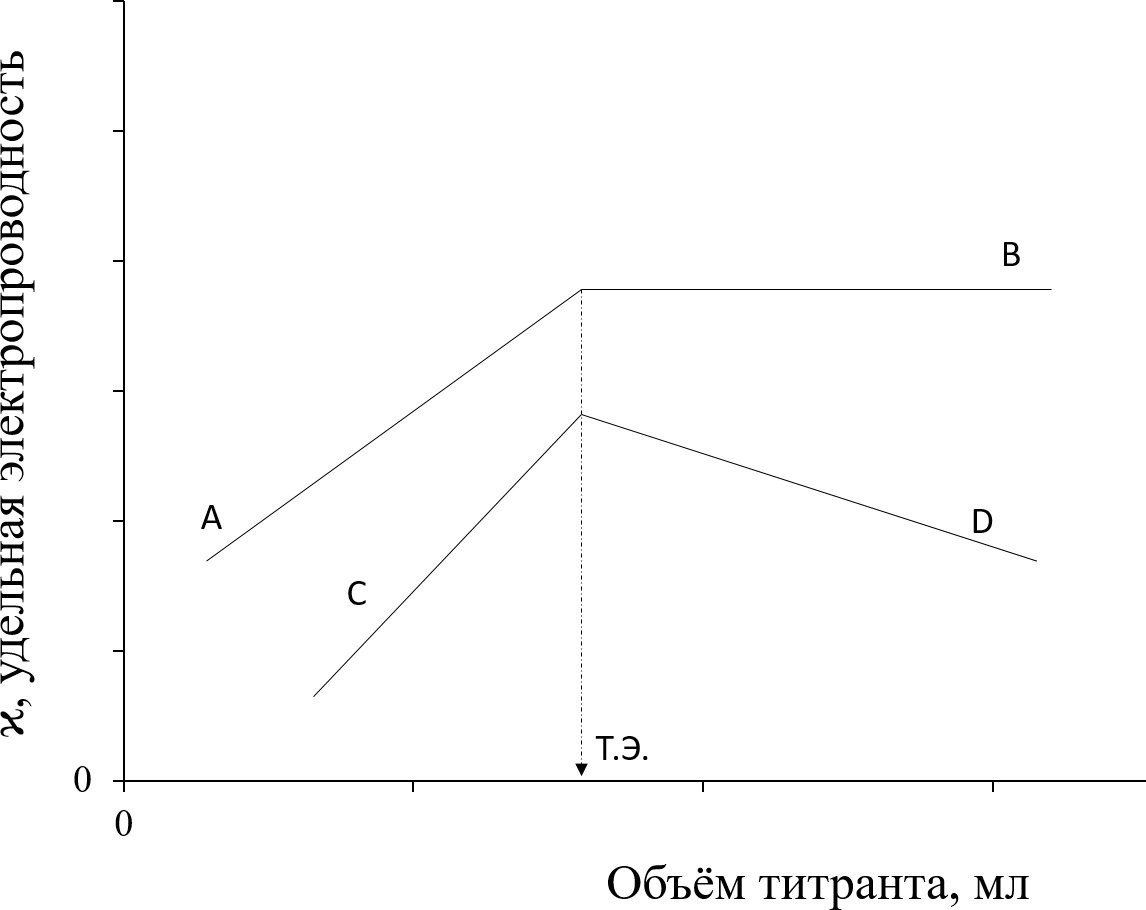
AB
- окислительно - восстановительное титрование
CD - ОВ титрование с
комплексообразованием

