Расчёт pH раствора гидролизующихся солей [47]
Гидролиз - это обменная реакция между ионами соли и молекулами воды, в результате которой образуются малодиссоциирующие молекулы и ионы.
Для описания сложных систем кроме уравнений, связывающих концентрации и константы гидролиза, используются уравнения материального баланса и электронейтральности.
- Уравнение материального баланса. Число атомов данного типа в изолированной
системе неизменно (закон сохранения массы). Например, известно, что при
образовании раствора угольной кислоты и воды (задаваемая при приготовлении
общая концентрация кислоты Co) в растворе (при каком-то
определенном рН) могут находиться следующие частицы:
H2CO3, HCO3-,
CO32-, H3O+,
OH−.
Балансовое уравнение по аниону кислоты будет иметь вид:
Co = [H2CO3] + [HCO3-] + [CO32-]. - Условие электронейтральности соблюдается для любого электролита: суммарный
заряд гомогенной жидкой системы, содержащий диссоциированный электролит, равен
нулю, т.е. общее число положительных зарядов равно общему числу отрицательных
зарядов.
Например, для водного раствора Ca(HCO3)2, в котором находятся ионы Ca2+, HCO3-, CO32-, H3O+, OH−, уравнение электронейтральности имеет вид:
2[Ca2+] - [HCO3-] - 2[CO32-] + [H3O+] + [OH−] = 0.
В растворе солей кроме реакции автопротолиза протекает реакция диссоциации соли. Ионы сильных кислот и оснований не взаимодействуют с водой и концентрация ионов гидроксония и гидроксила в растворах этих солей такая же, как и в чистой воде, но активность ионов гидроксония в растворах солей отличается от активности этих ионов в чистой воде, что может вызвать изменение pH раствора! Процесс гидролиза происходит лишь в случаях:
В данном случае проиходит гидролиз по катиону соли.
Задача №1:
Рассчитайте pH 0,01 M раствора сульфата аммония в воде, если Kb аммиака равна 1,76 * 10−5, Kw = 1,0 * 10-14.
Дано:
Kb
= 1,76 * 10−5
Kw = 1,0 *
10-14
Cобщ. = 0,01 моль/л
pH - ?
Решение:
В
водном растворе сульфата аммония протекают следующие реакции, характеризующиеся
глубиной протекания x:
H2O + H2O ↔
H3O+ +
OH-
x1
(NH4)2SO4 + H2O ↔
2NH4+ +
SO42- x2
NH4+
+ H2O ↔ H3O+ +
NH3
x3
Равновесие описывается системой уравнений:
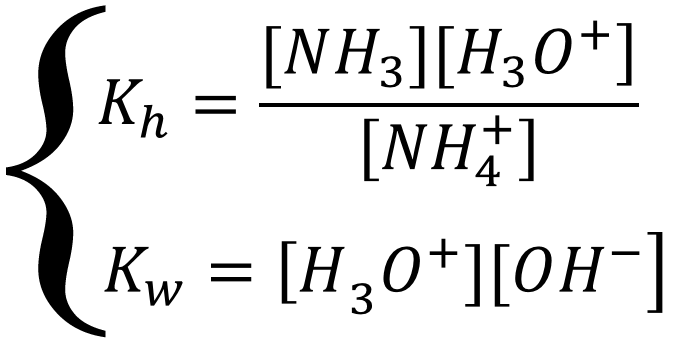
Выразим все равновесные концентрации через глубины протекания трёх реакций. Соль в растворе диссоциирует нацело, значит концентрация иона-аммония равна удвоенной концентрации соли, а гидролизу подвергается только часть ионов, соответственно: [NH4+] = 2x2 - x3 = 2Cобщ - x3; [OH-] = x1; [H3O+] = x1 + x3; [NH3] = x3; подставим в систему уравнений:
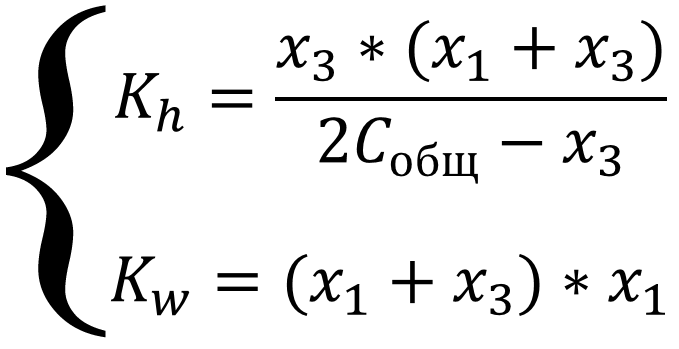
Систему можно упростить, если в уравнениях там, где стоит алгебраическая сумма, пренебречь меньшими слагаемыми из уравнения автопротолиза x1, так как процесс автопротолиза значительно уступает остальным процессам в системе:
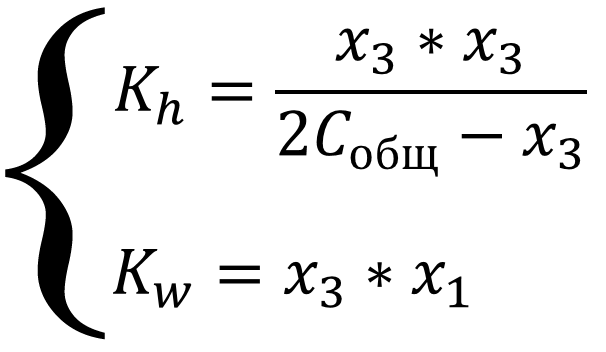
Выражение для константы гидролиза имеет вид обычного квадратного уравнения, рассчитаем сначала x3, а потом x1 из выражения для константы автопротолиза, так же учтём связь констант гидролиза и основности аммиака:
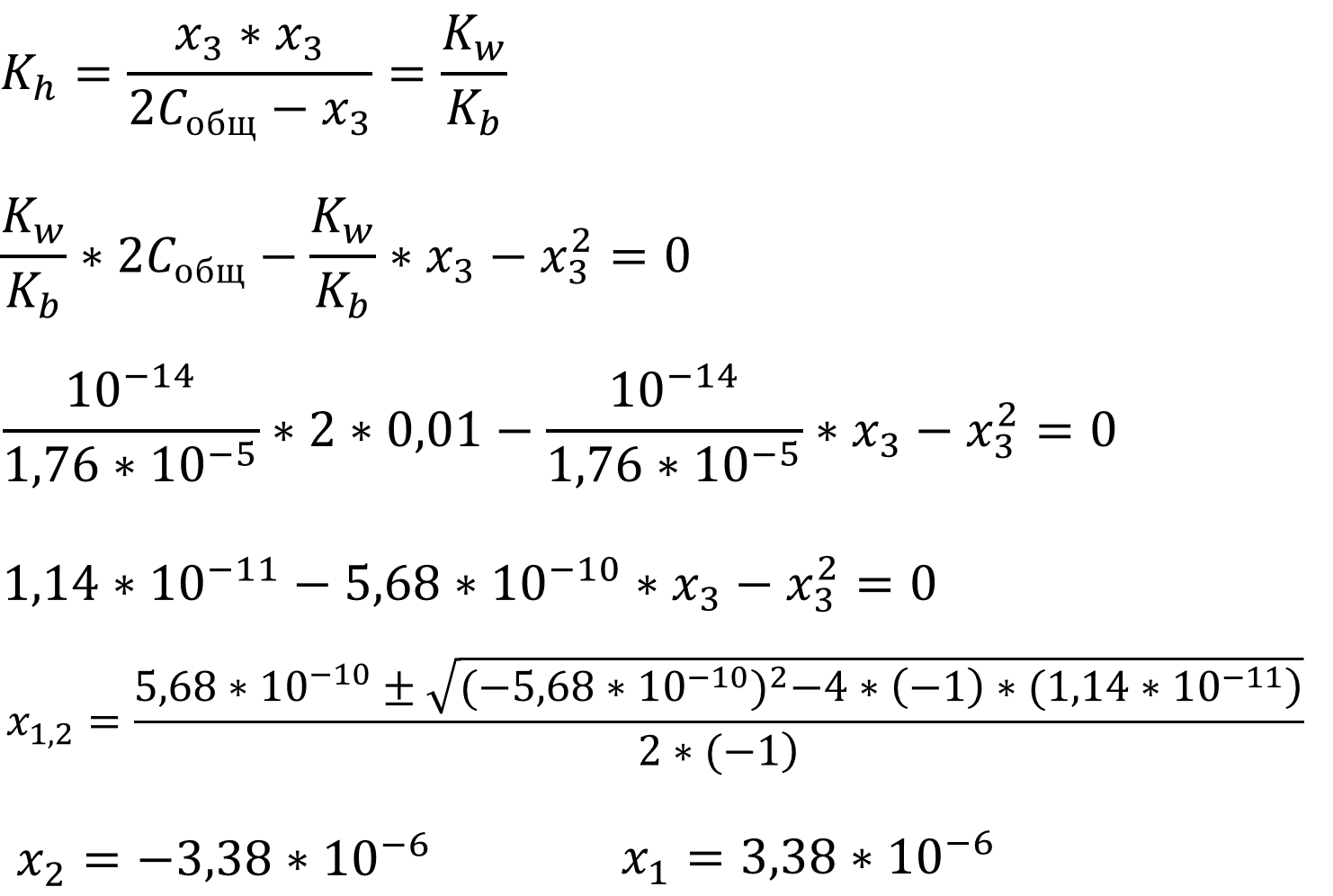
Так как мы ищем концентрацию, которая не может быть отрицательной, то верным считается положительный корень уравнения, соответственно:
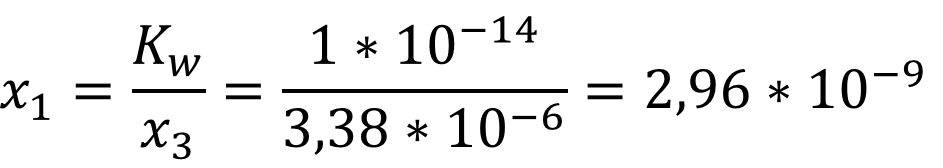
Из
исходных уравнений рассчитаем концентрацию ионов-гидроксония входящих в раствор
и pH:
[H3O+] = x1 + x3 = 3,38 *
10-6 + 2,96 * 10-9 = 3,38 * 10-6;
pH =
-lg[H3O+] = -lg 3,38 * 10-6 = 5,47
Ответ: pH = 5,47
Таким образом полученный результат
показывает, что при гидролизе по катиону выделяется дополнительное количество
ионов гидроксония, то есть среда подкисляется!!!
Полученный результат также
показывает, что сделанное ранее допущение о том, что x1 <<
x3, верное. При анализе сложных систем всегда стоит учитывать
значимость тех или иных процессов, для последующего упрощения системы
уравнений!!!
В данном случае проиходит гидролиз по аниону соли.
Задача №2:
Рассчитайте pH 0,01 M раствора карбоната натрия в воде, если Ka1 = 4,5 * 10−7, Ka2 = 5,0 * 10−11 и Kw = 1,0 * 10-14.
Дано:
Ka1
= 4,5 * 10−7
Ka2 = 5,0 *
10−11
Kw = 1,0 * 10-14
Cобщ. =
0,01 моль/л
pH - ?
Решение:
В
водном растворе карбоната натрия протекают следующие реакции, характеризующиеся
глубиной протекания x:
H2O + H2O ↔
H3O+ +
OH-
x1
Na2CO3 + H2O ↔ 2Na+
+
CO32-
x2
CO32- + H2O ↔ OH- +
HCO3- x3
HCO3-
+ H2O ↔ OH- +
H2CO3
x4
Равновесие описывается системой уравнений:
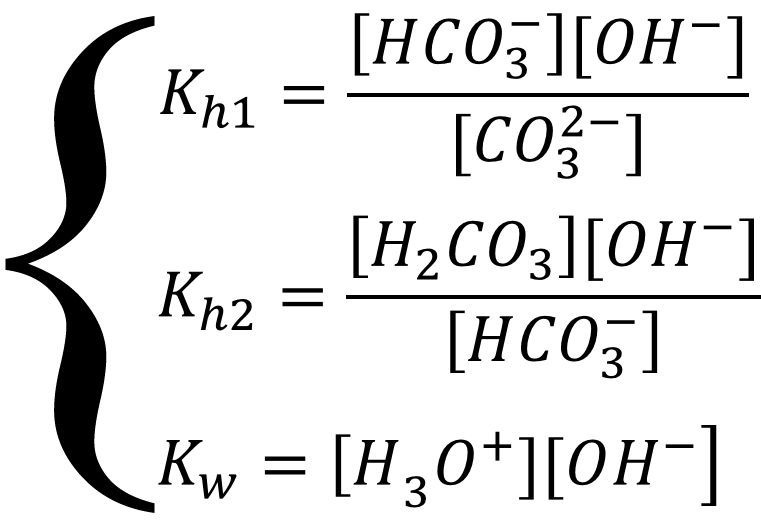
Выразим все равновесные концентрации через глубины протекания трёх реакций. Соль в растворе диссоциирует нацело, значит концентрация аниона равна концентрации соли, а гидролизу подвергается только часть ионов, соответственно: [CO32-] = x2 - x3 = Cобщ - x3; [OH-] = x1 + x3 + x4; [H3O+] = x1; [HCO3-] = x3 - x4; [H2CO3] = x4; подставим в систему уравнений:
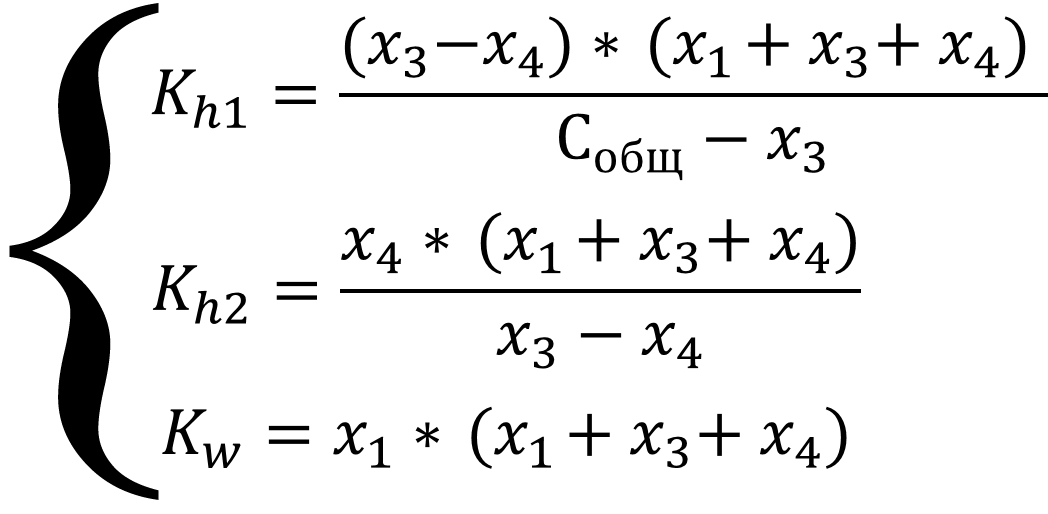
Систему можно упростить, если в уравнениях там, где стоит алгебраическая сумма, пренебречь меньшими слагаемыми из уравнения автопротолиза x1, так как процесс автопротолиза значительно уступает остальным процессам в системе и x4, так как выделение гидроксил-ионов подавляет вторую ступень гидролиза:
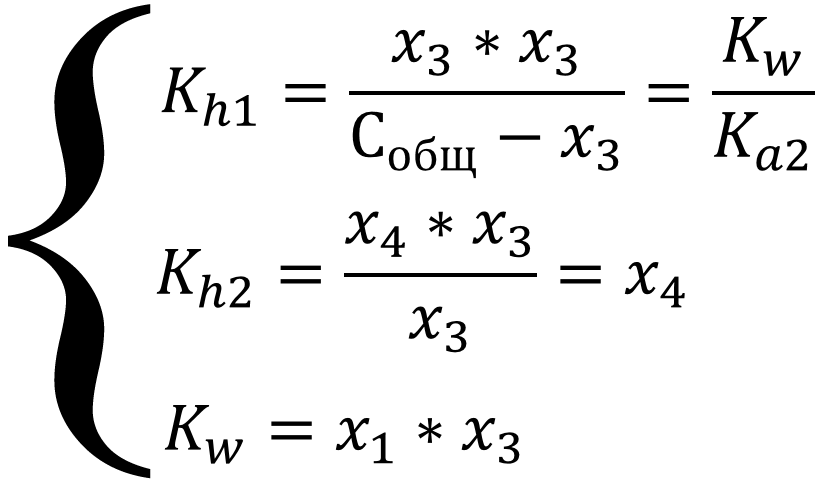
Выражение для константы гидролиза первой ступени имеет вид обычного квадратного уравнения, рассчитаем сначала x3, а потом x1 и x4 из выражения для константы автопротолиза и гидролиза по второй ступени, так же учтём связь констант гидролиза и кислотности угольной кислоты, в данном случае Ka2, согласно уравнению гидролиза по первой ступени:

Так как мы ищем концентрацию, которая не может быть отрицательной, то верным считается положительный корень уравнения, соответственно:
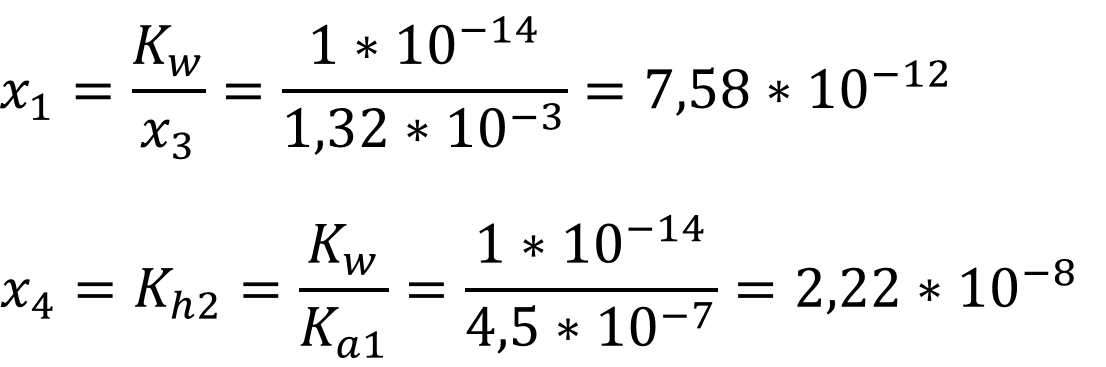
Из
исходных уравнений рассчитаем концентрацию гидроксил-ионов входящих в раствор и
pH:
[OH-] = x1 + x3 + x4 = 7,58
* 10-12 + 1,32 * 10-3 + 2,22 * 10-8 = 1,32 *
10-3;
pH = 14 + lg[OH-] = 14 + lg 1,32 *
10-3 = 11,1
Ответ: pH = 11,1
Таким образом полученный результат
показывает, что при гидролизе по аниону выделяется дополнительное количество
гидроксил-ионов, то есть среда подщелачивается!!!
В данном случае проиходит гидролиз по катиону и по аниону соли.
Задача №3:
Расссчитайте pH 0,01 M раствора формиата аммония в воде, если Kb аммиака равна 1,76 * 10−5, Ka муравьиной кислоты равна 1,78 * 10−4, Kw = 1,0 * 10-14.
Дано:
Kb
= 1,76 * 10−5
Ka = 1,78 *
10−4
Kw = 1,0 * 10-14
Cобщ. =
0,01 моль/л
pH - ?
Решение:
В
водном растворе формиата аммония протекают следующие реакции,
характеризующиеся глубиной протекания x:
H2O + H2O ↔
H3O+ +
OH- x1
HCOONH4
+ H2O ↔ NH4+ +
HCOO-
x2
NH4+ + H2O ↔
H3O+ +
NH3 x3
HCOO-
+ H2O ↔ OH- +
HCOOH
x4
Равновесие описывается системой уравнений:
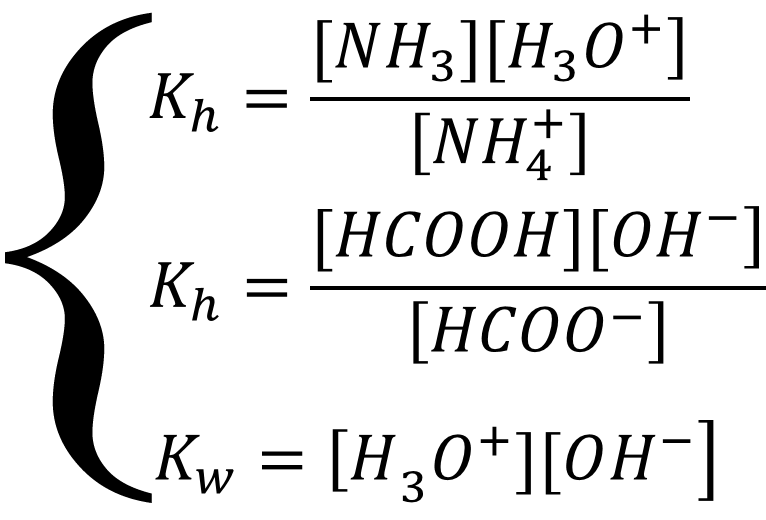
Для того чтобы найти концентрацию ионов гидроксония, разделим константы гидролиза друг на друга, предварительно выразив неизвестные константы гидролиза через константы кислотности/основности:
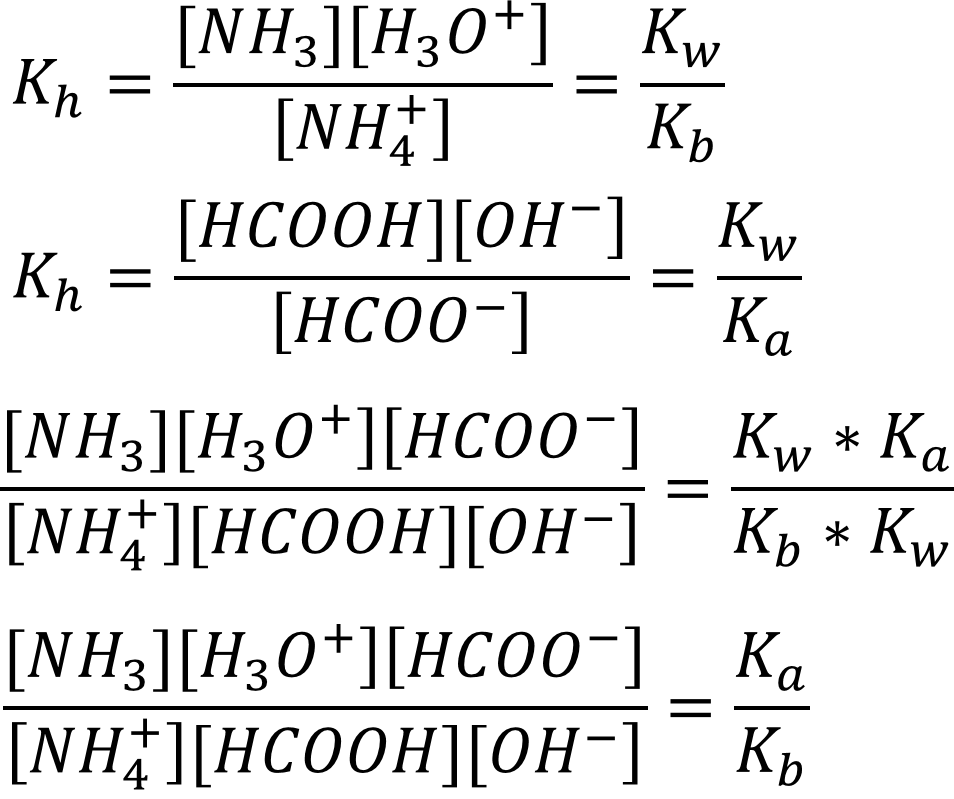
Для того чтобы выразить неизвестную величину [OH-] через известное Kw, разделим обе части уравнения на [H3O+]2:
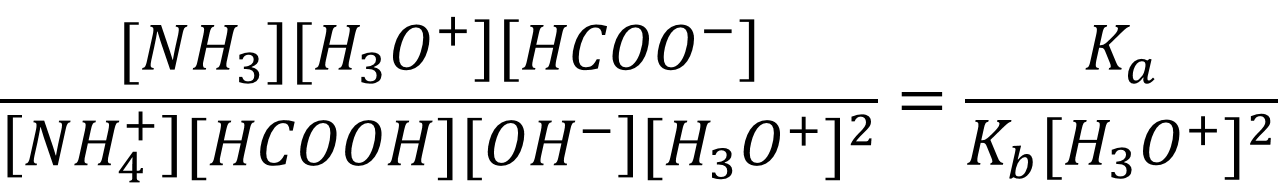
После сокращения получаем:
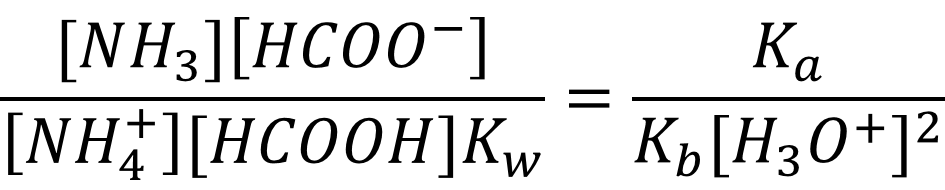
Выразим все равновесные концентрации через глубины протекания трёх реакций. Соль в растворе диссоциирует нацело, значит концентрация иона-аммония и формиат-иона равна концентрации соли, а гидролизу подвергается только часть ионов, соответственно: [NH4+] = x2 - x3 = Cобщ - x3; [NH3] = x3; [HCOOH] = x4; [HCOO-] = x2 - x4 = Cобщ - x4 и подставим полученное в уравнение:
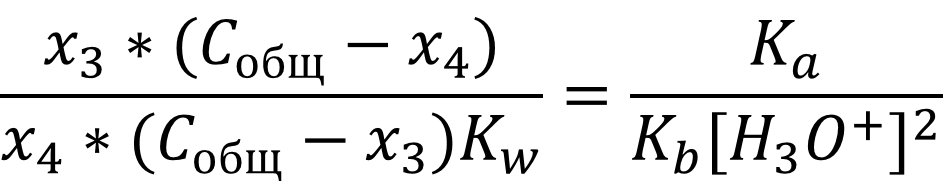
Систему можно упростить, если принять во внимание, что согласно уравнению электронейтральности [HCOO-] = [NH4+], соответственно Cобщ - x3 = Cобщ - x4, а x3 = x4:
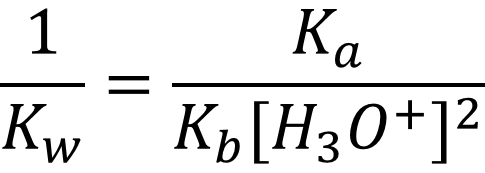
В итоге получаем выражение для расчёта pH водных растворов солей, образованных слабыми кислотами и основаниями (амфолитов):
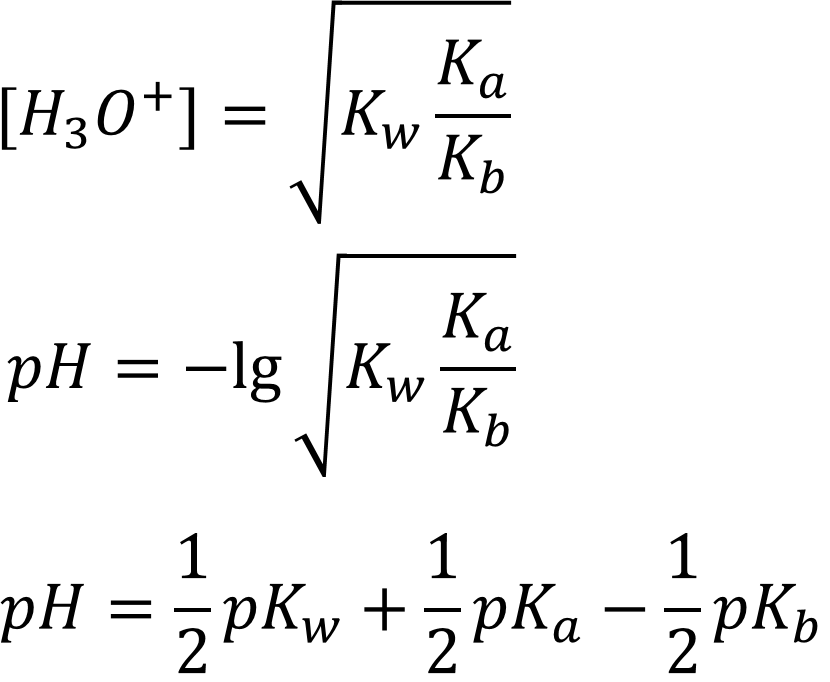
Рассчитаем pH раствора для нашего случая:
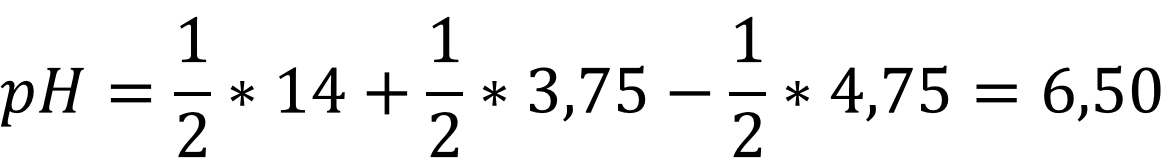
Ответ: pH = 6,50 - согласно результату сила кислоты
больше нежели сила основания и среда подкисляется!!!
Таким образом полученный
результат показывает, что при совместном гидролизе pH зависит от отношения силы
кислоты к силе основания и не зависит от концентрации соли!!!

