Расчёт pH раствора в неводных растворителях [47]
Измеренная по отношению к стандарту в данном растворителе рН не является абсолютном мерой кислотности неводного раствора и может быть использована для характеристики кислотности только в пределах данного растворителя. Это следует из того, что начало шкалы кислотности рН = 0 не соответствует равенству абсолютных активностей ионов водорода во всех растворителях. Величины рН нейтральных растворов в разных растворителях не совпадают друг с другом, так как протяженность шкал, зависящая от ионного произведения растворителя, различна. Для воды pKw = 14.
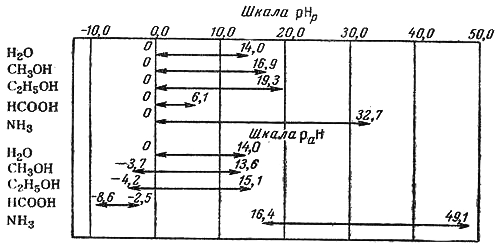
В воде шкала рН изменяется от 0 до 14; нейтральным раствором называется раствор с рН = 7. Если раствор имеет рН = 0, это раствор кислоты с активностью ионов Н+, равной единице; если раствор имеет рН = 14, это раствор щелочи с активностью ионов ОН-, равной единице, но это не значит, что не может быть растворов в воде с рН меньше нуля и больше 14.
Математический аппарат, используемый для нахождения рН водных растворов кислот и оснований, пригоден для расчета рН кислот и оснований в любом растворителе. Единственное, что будет отличаться, это справочные данные: вместо ионного произведения воды необходимо взять из справочных таблиц значение константы автопротолиза соответствующего растворителя и значение константы диссоциации кислоты (основания) в том же растворителе.
Задача №1:
Рассчитайте pH 0,01 M раствора трихлоруксусной кислоты в воде и этиловом спирте, если pKa (H2O) = 0,77; Kw = 1,0 * 10-14; константа автопротолиза спирта равна 1,0 * 10-19.
Дано:
pKa
= 0,77
Kw = 1,0 *
10-14
KC2H5OH = 1,0 *
10-19
CM = 0,01 моль/л
pH - ?
Решение:
Согласно велечине константы кислотности трихлоруксусная кислота-очень сильная! В разбавленном растворе очень сильной кислоты pH раствора зависит только от активности иона лиония, для воды - гидроксоний-иона [H3O+] и для спитра - этилоксония[C2H5OH2+]. В разбавленном растворе сильная кислота диссоциирует полностью, а активность равна коцентрации кислоты. Соответственно:
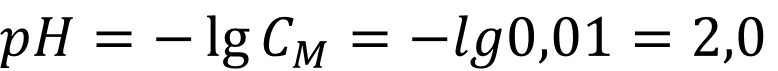
Ответ: pH = 2,0 - как видно из расчётов значение pH сильных кислот не меняется в разбавленных растворах, но меняется в концентрированных, так как есть существенная разница между активностями ионов лиония различных растворителей. Так же видно, что шкала pH для этанола 19 единиц, а значит нейтральная среда в этаноле достигается при существенно меньших концентрациях кислоты.
Задача №2:
Рассчитайте pH 0,01 M раствора едкого кали в воде и этиловом спирте, если Kw = 1,0 * 10-14; константа автопротолиза спирта равна 1,0 * 10-19.
Дано:
Kw
= 1,0 * 10-14
KC2H5OH = 1,0 *
10-19
CM = 0,01 моль/л
pH - ?
Решение:
В растворе очень сильного основания pH зависит только от величины показателя константы автопротолиза растворителя и активности иона лиата, для воды - гидроксил-иона [OH-] и для спитра - этилоксида [C2H5O-]. В разбавленном растворе сильное основание диссоциирует полностью, а активность равна коцентрации основания. Соответственно для воды:
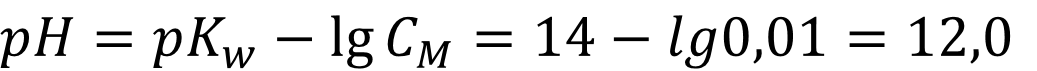
Для спирта:
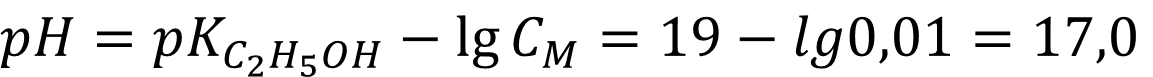
Ответ: Для воды pH = 12,0; для спирта pH = 17,0 - как видно из расчётов значение pH сильных оснований меняется по величине от растворителя к растворителю.
Задача №3:
Рассчитайте pH 0,01 M раствора уксусной кислоты в воде и этиловом спирте, если pKa(в этаноле) = 10,3; Kw = 1,0 * 10-14; константа автопротолиза спирта равна 1,0 * 10-19.
Дано:
pKa
(в этаноле) = 10,3
Ka (в воде) = 1,75 *
10-5
Kw = 1,0 *
10-14
KC2H5OH = 1,0 *
10-19
CM = 0,01 моль/л
pH - ?
Решение:
В растворе слабой кислоты расчёт pH производится с учётом автопротолиза или без учёта в зависимости от степени диссоциации слабого электролита и его концентрации. Рассчитаем степени диссоциации уксусной кислоты в двух растворителях:
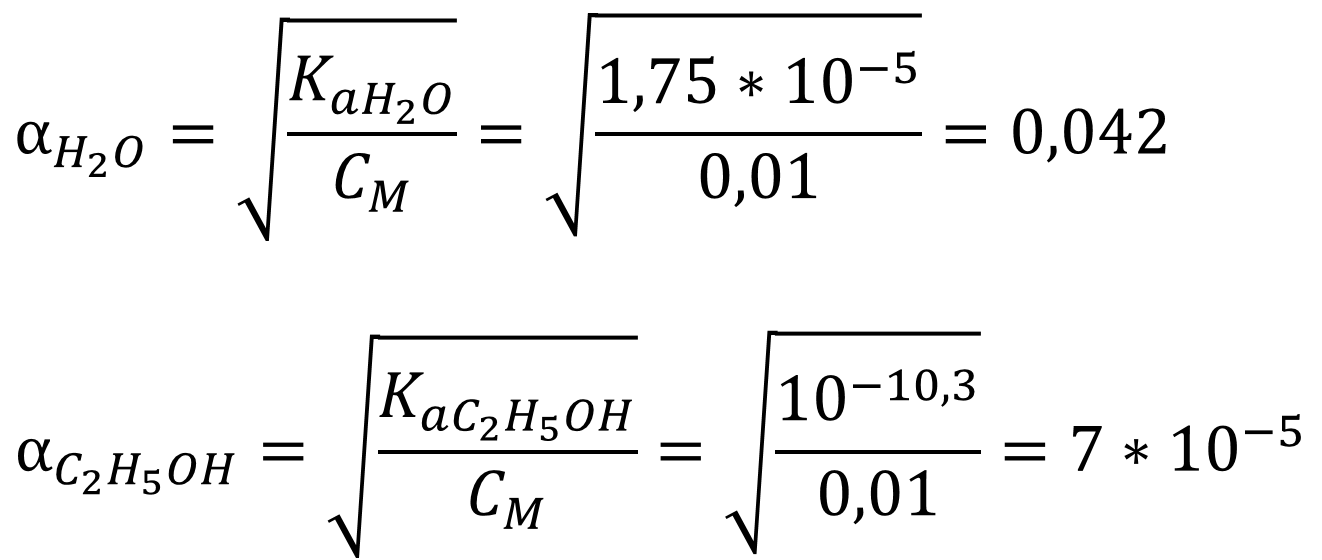
Так как степень диссоциации кислоты в воде около 5 % (4,2 %), то для воды проведём расчёт pH без учёта автопротолиза:
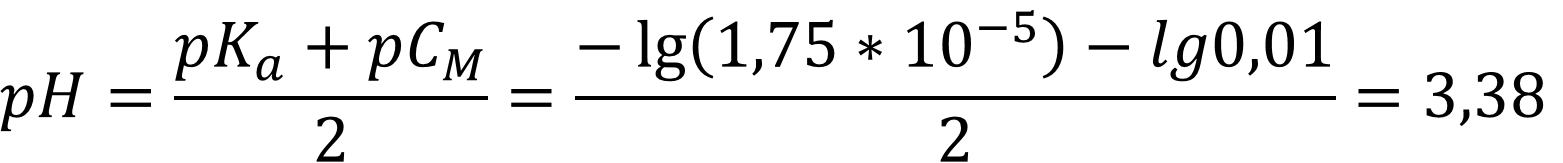
В этаноле степень диссоциации кислоты значительно меньше 5 %, а потому расчёт ведётся с учётом автопротолиза растворителя по формуле:
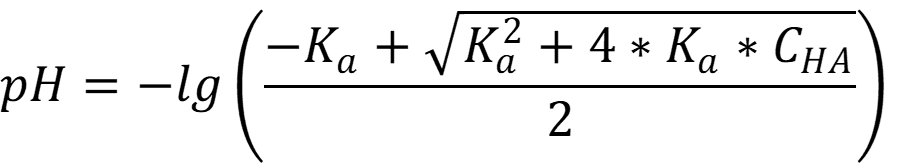
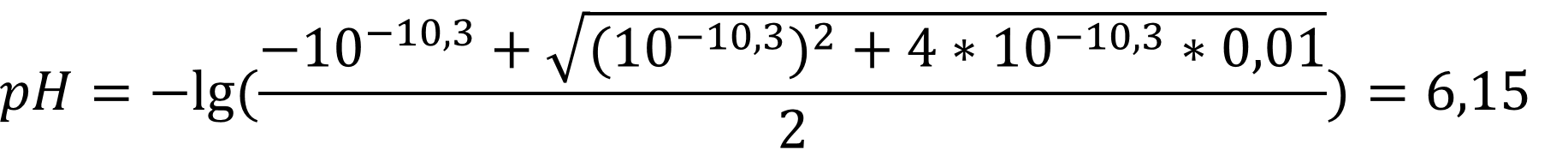
Ответ: Для воды pH = 3,38; для спирта pH = 6,15 - как видно из расчётов значение pH слабой уксусной кислоты далеко от нейтрального значения (7 и 9,5 единиц) и сильно отличается по величине.
Задача №4:
Рассчитайте pH 0,01 M раствора анилина в воде и этиловом спирте, если pKb(в этаноле) = 13,3; Kw = 1,0 * 10-14; константа автопротолиза спирта равна 1,0 * 10-19.
Дано:
pKb
(в этаноле) = 13,3
Kb (в воде) = 4,3 *
10-10
Kw = 1,0 *
10-14
KC2H5OH = 1,0 *
10-19
CM = 0,01 моль/л
pH - ?
Решение:
В растворе слабого основания расчёт pH производится с учётом автопротолиза или без учёта в зависимости от степени диссоциации слабого электролита и его концентрации. Рассчитаем степени диссоциации анилина в двух растворителях:
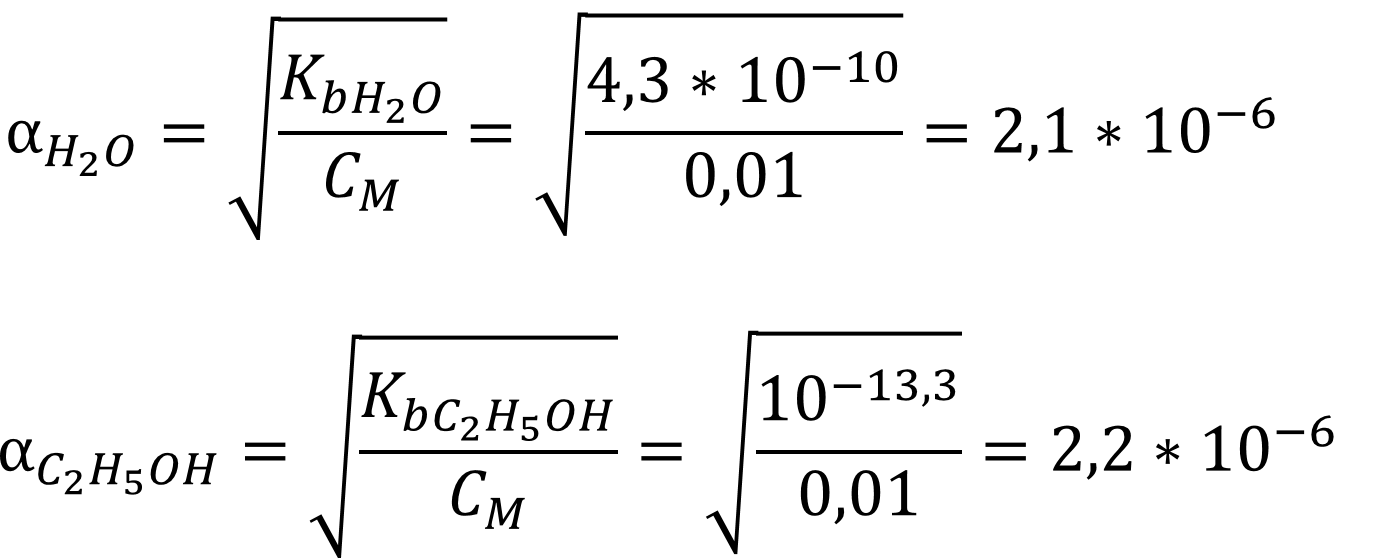
Так как степень диссоциации основания далека от 5 % в обоих растворителях, то расчёт pH ведём по формуле:
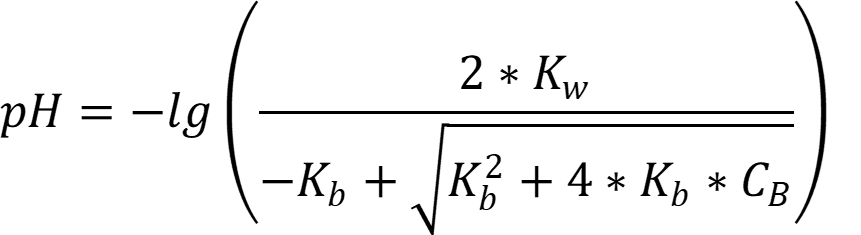
Соответственно для воды:
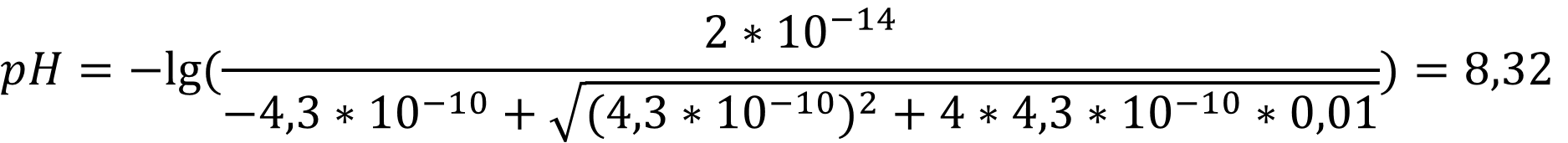
Для этанола:
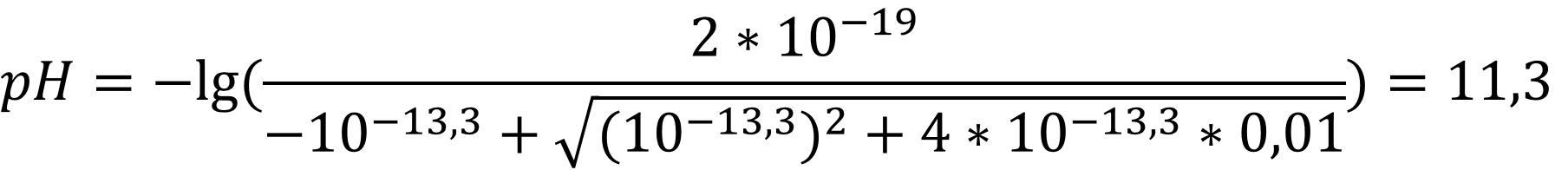
Ответ: Для воды pH = 8,32; для спирта pH = 11,3 - как видно из расчётов значение pH очень слабого основания близко к нейтральному значению (7 и 9,5 единиц) и отличается по величине.

