Расчёт состава раствора [47]
Для описания сложных систем кроме уравнений, связывающих концентрации и константы ионизации, используются уравнения материального баланса и электронейтральности.
- Уравнение материального баланса. Число атомов данного типа в изолированной
системе неизменно (закон сохранения массы). Например, известно, что при
образовании раствора угольной кислоты и воды (задаваемая при приготовлении
общая концентрация кислоты Co) в растворе (при каком-то
определенном рН) могут находиться следующие частицы:
H2CO3, HCO3-,
CO32-, H3O+,
OH−.
Балансовое уравнение по аниону кислоты будет иметь вид:
Co = [H2CO3] + [HCO3-] + [CO32-]. - Условие электронейтральности соблюдается для любого электролита: суммарный
заряд гомогенной жидкой системы, содержащий диссоциированный электролит, равен
нулю, т.е. общее число положительных зарядов равно общему числу отрицательных
зарядов.
Например, для водного раствора Ca(HCO3)2, в котором находятся ионы Ca2+, HCO3-, CO32-, H3O+, OH−, уравнение электронейтральности имеет вид:
2[Ca2+] - [HCO3-] - 2[CO32-] + [H3O+] + [OH−] = 0.
В водном растворе слабой трёхосновной кислоты возможно протекание следующих линейно независимых реакций: реакции автопротолиза воды и реакции ионизации слабой кислоты по трём ступеням. Оснований диссоциирующих по трём ступеням достаточно мало и они не будут рассмотрены здесь!
Задача №1:
Имеется водный раствор мышьяковой кислоты, концентрация которой 0,01 моль/л. Справочные данные: Ka1 = 6,46 * 10−3, Ka2 = 1,15 * 10−7, Ka3 = 3,16 * 10−12, Kw = 1,0 * 10-14. Найти концентрации всех ионов в данном растворе.
Дано:
Ka1
= 6,46 * 10−3
Ka2 = 1,15 *
10−7
Ka3 = 3,16 * 10−12
Kw =
1,0 * 10-14
Cобщ. = 0,01
моль/л
[H3O+], [H3AsO4],
[H2AsO4-], [HAsO42-],
[AsO43-] - ?
Решение:
В
водном растворе мышьяковой кислоты протекают следующие реакции,
характеризующиеся глубиной протекания x:
H2O + H2O ↔
H3O+ +
OH-
x1
H3AsO4 + H2O ↔
H3O+ +
H2AsO4-
x2
H2AsO4- + H2O ↔
H3O+ +
HAsO42-
x3
HAsO42- + H2O ↔
H3O+ +
AsO43-
x4
Равновесие описывается системой уравнений:

Выразим все равновесные концентрации через глубины протекания четырёх реакций: [H3O+] = x1 + x2 + x3 + x4; [OH-] = x1; [H2AsO4-] = x2 - x3; [HAsO42-] = x3 - x4; [AsO43-] = x4; [H3AsO4] = Cобщ - x2 и подставим в систему уравнений:
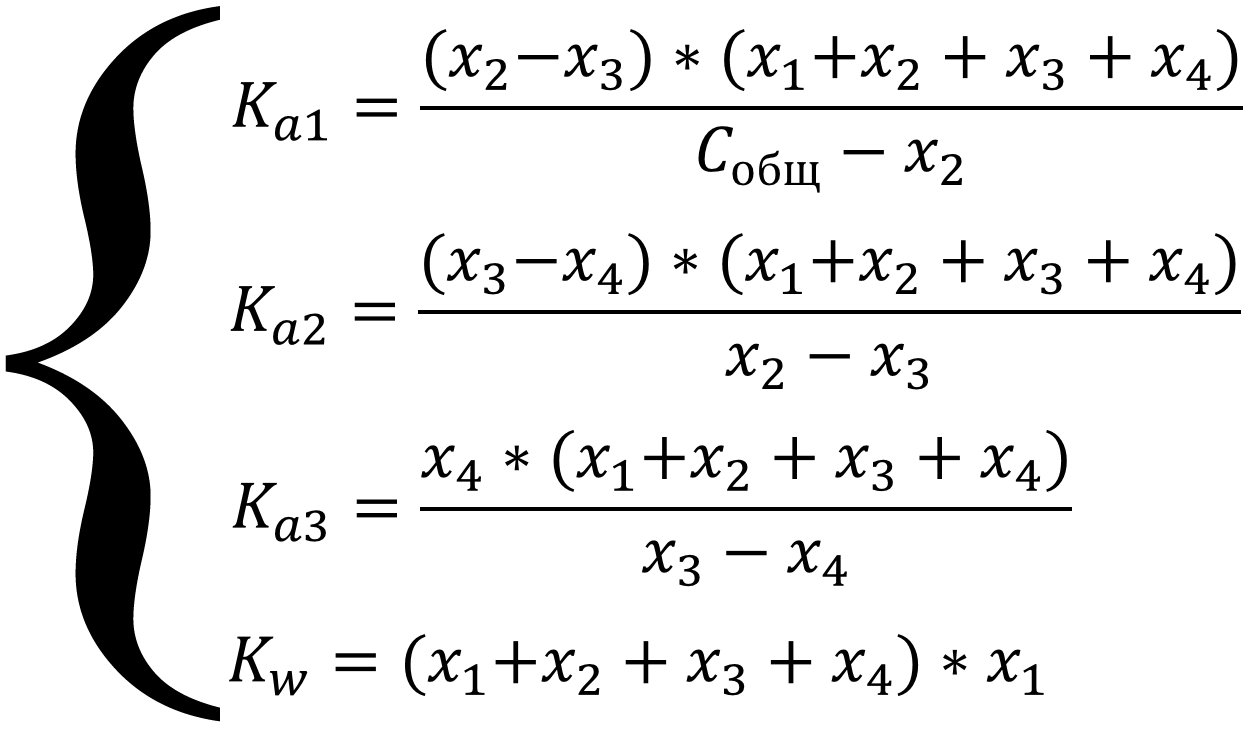
Систему можно упростить, если в уравнениях там, где стоит алгебраическая сумма, пренебречь меньшими слагаемыми из уравнения автопротолиза x1 и слагаемыми x3 и x4, так как вторая и третья ступень диссоциации подавляется ионами водорода выделяющимися при диссоциации по первой ступени, т.е. x1, x3 и x4 << x2, а так же x4 << x3 тогда уравнения примут вид:

Выражение для первой константы кислотности имеет вид обычного квадратного уравнения, рассчитаем сначала x2, а потом x1, x3 и x4 из выражения для константы автопротолиза, второй и третьей ступени ионизации кислоты:
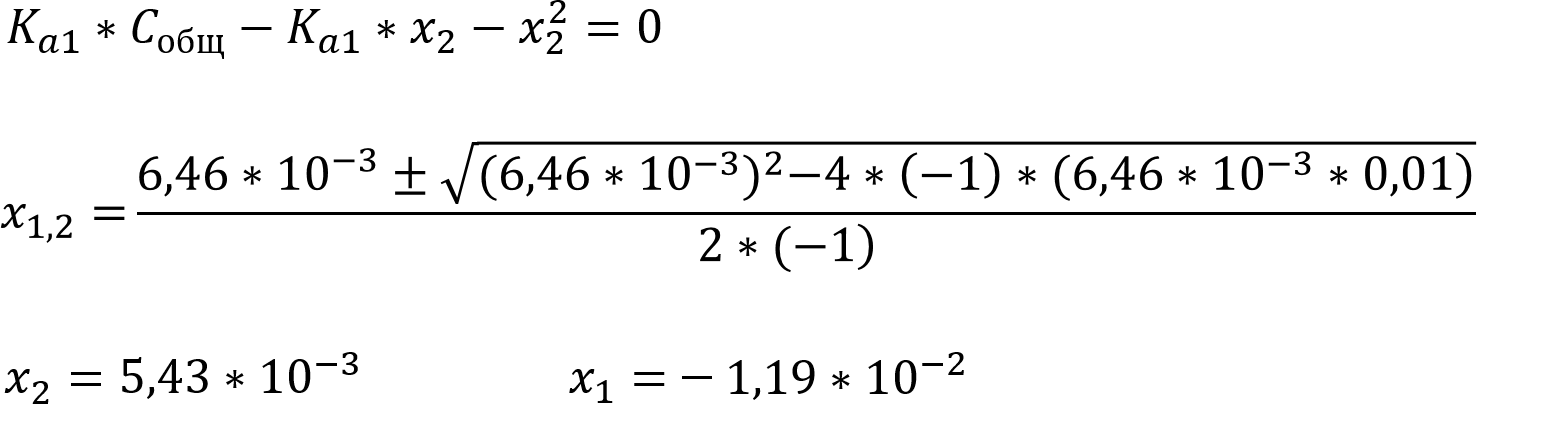
Так как мы ищем концентрацию, которая не может быть отрицательной, то верным считается положительный корень уравнения, соответственно:
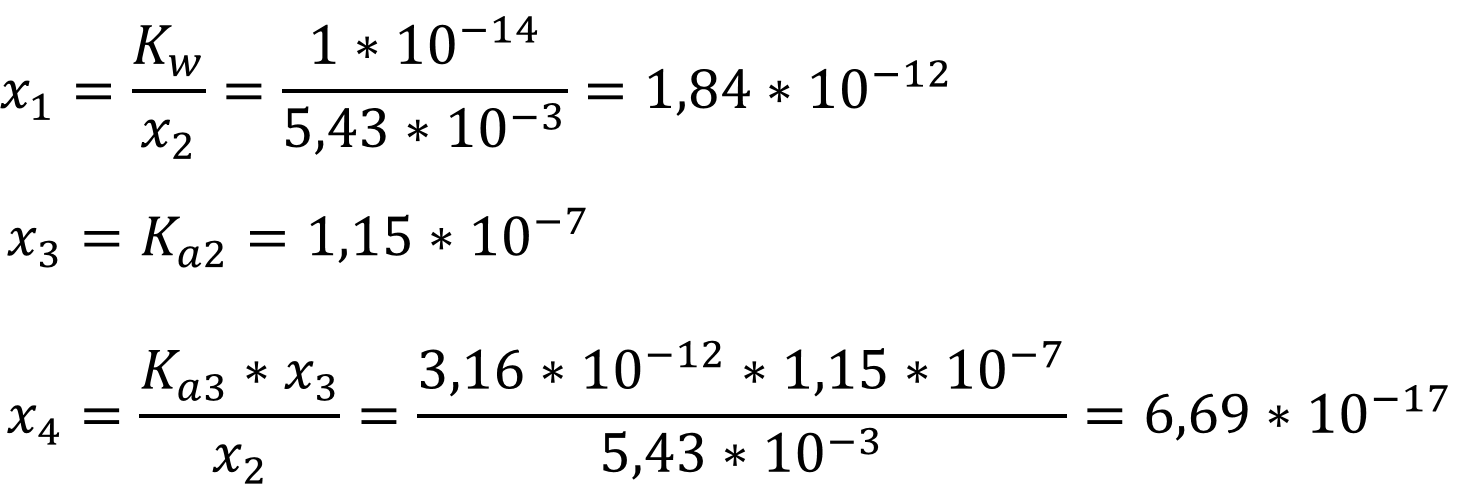
Из
исходных уравнений рассчитаем концентрации ионов входящих в раствор:
[H3O+] = x1 + x2 + x3
+ x3 = 0,00543 моль/л;
pH = -lg[H3O+] =
2,26;
[OH-] = x1 = 1,84 * 10−12 моль/л;
[H2AsO4-] = x2 - x3 =
0,00543 моль/л;
[HAsO42-] = x3 -
x4 = 1,15 * 10-7 моль/л;
[AsO43-]
= x4 = = 6,69 * 10−17
моль/л
[H3AsO4] = Cобщ - x2 =
0,01 - 0,00543 = 0,00457 моль/л.
Ответ: [H3O+] = 0,00543 моль/л;
pH = 2,26;
[OH-] = 1,84 * 10−12 моль/л;
[H2AsO4-] = 0,00543 моль/л;
[HAsO42-] = 1,15 * 10-7
моль/л;
[AsO43-] = 6,69 * 10−17
моль/л
[H3AsO4] = 0,00457 моль/л.
Полученный
результат показывает, что сделанное ранее допущение о том, что x1,
x3 и x4 << x2, верное. При
анализе сложных систем всегда стоит учитывать значимость тех или иных процессов,
для последующего упрощения системы уравнений!!!
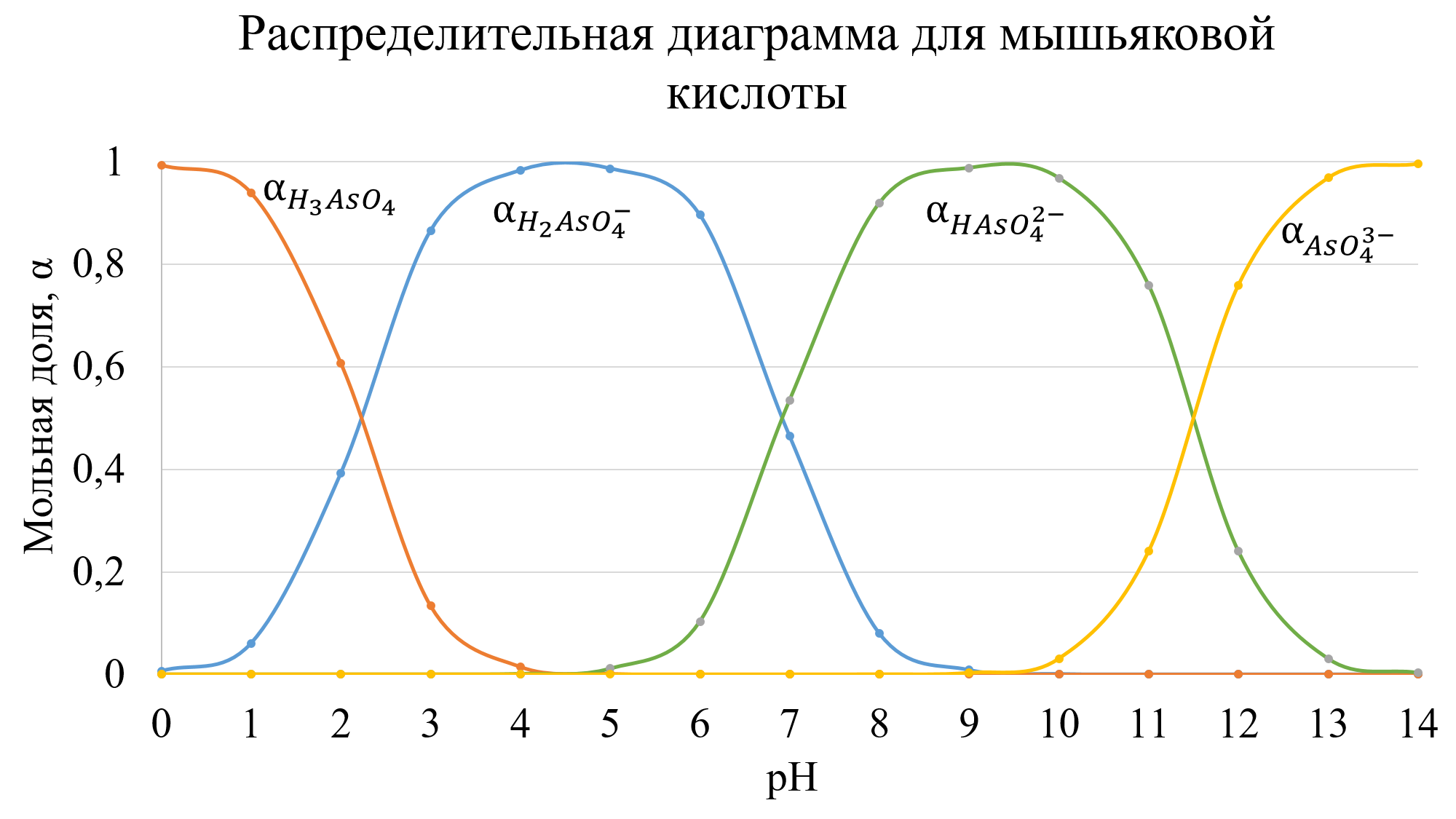
Распределительная диаграмма − это графический образ, позволяющий оценить распределение различных возможных форм какого−либо соединения в зависимости от определенного параметра. Обычно изображают графические зависимости долевых концентраций различных форм от величины pH (все формы на одном графике) и получают таким образом распределительную диаграмму. При построении распределительных диаграмм делают допущения:
- пренебрегают вкладом реакции автопротолиза воды в общий процесс;
- принимают активности ионных форм равными их концентрациям, т.е. пренебрегают силами взаимодействия между ионами, молекулами.
Мольная доля − это отношение равновесной концентрации данного иона к общей концентрации всех форм ионов. После упрощения для трёхосновной кислоты имеем:
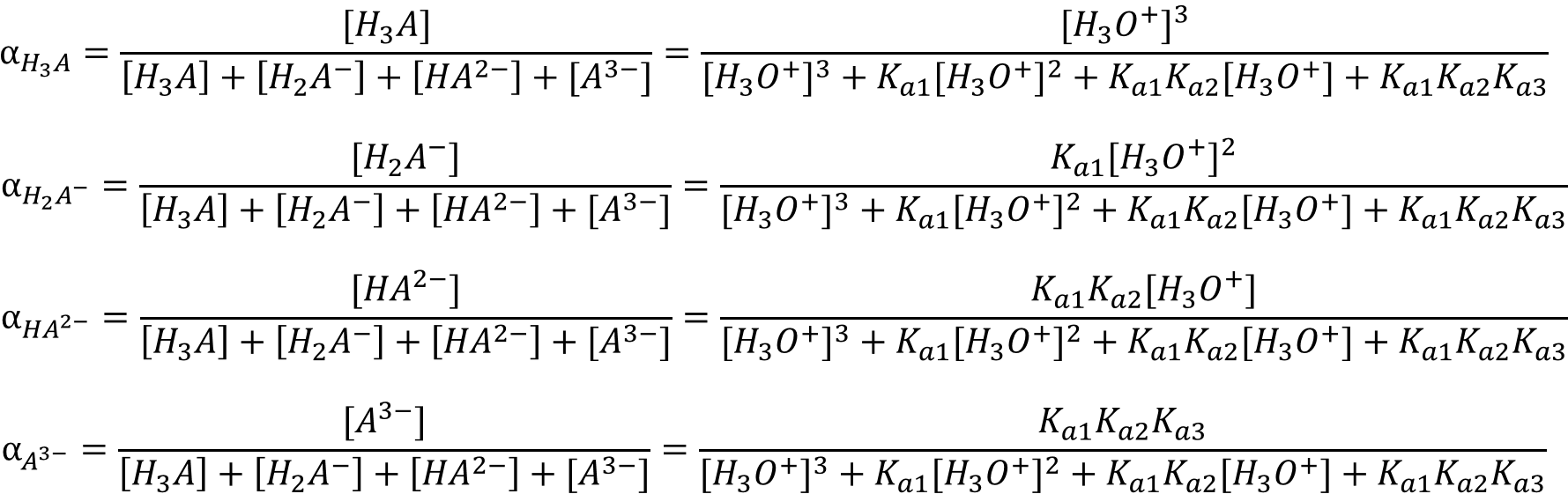
Для мышьяковой кислоты с Ka1 = 6,46 * 10−3, Ka2 = 1,15 * 10−7 и Ka3 = 3,16 * 10−12 диаграмма имеет вид: