Расчёт степени гидролиза солей
Гидролиз - это обменная реакция между ионами соли и молекулами воды, в результате которой образуются малодиссоциирующие молекулы и ионы.
Степень
гидролиза — это отношение количества (концентрации) соли, которая вступает в
реакцию гидролиза, к общему количеству (концентрации) растворённой соли.
Степень гидролиза зависит от:
Задача №1:
Рассчитайте степень гидролиза 0,01 M раствора сульфата аммония в воде, если Kb аммиака равна 1,76 * 10−5, Kw = 1,0 * 10-14.
Дано:
Kb
= 1,76 * 10−5
Kw = 1,0 *
10-14
CM = 0,01 моль/л
h - ?
Решение:
В
водном растворе сульфата аммония протекают следующие реакции:
H2O
+ H2O ↔ H3O+ +
OH-
(NH4)2SO4 + H2O ↔
2NH4+ +
SO42-
NH4+ + H2O ↔
H3O+ + NH3
Гидролиз протекает по одной ступени по катиону, соответственно:
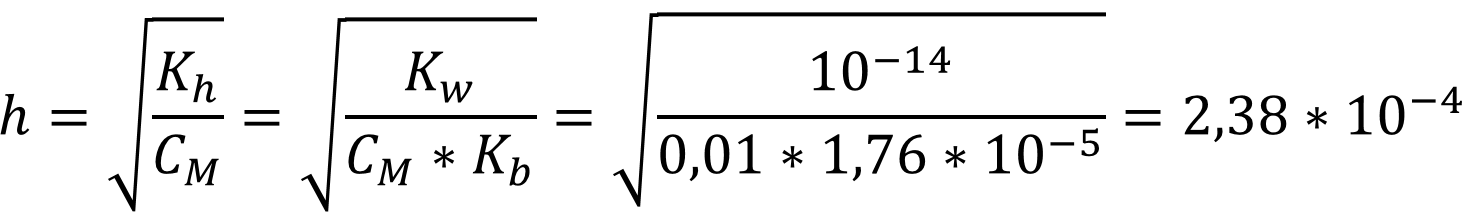
Ответ: h = 2,38 * 10-4
Задача №2:
Рассчитайте степень гидролиза 0,01 M раствора сульфида натрия в воде, если для сероводородной кислоты Ka1 = 1,0 * 10−7, Ka2 = 1,3 * 10−13, Kw = 1,0 * 10-14.
Дано:
Ka1
= 1,0 * 10−7
Ka2 = 1,3 *
10−13
Kw = 1,0 * 10-14
CM =
0,01 моль/л
h - ?
Решение:
В
водном растворе сульфида натрия протекают следующие реакции:
H2O
+ H2O ↔ H3O+ + OH-
Na2S + H2O ↔ 2Na+ + S2-
S2- + H2O ↔ OH- + HS-
HS- + H2O ↔ OH- + H2S
Исходя из данных константа диссоциации по второй ступени на шесть порядков меньше первой, а значит и константа гидролиза будет значительно больше. Соответственно при протекании гидролиза по первой ступени, выделившиеся гидроксид-ионы будут ослаблять и без того более слабый процесс гидролиза по второй ступени!!! При расчётах учитываем константу кислотности по второй ступени!!!
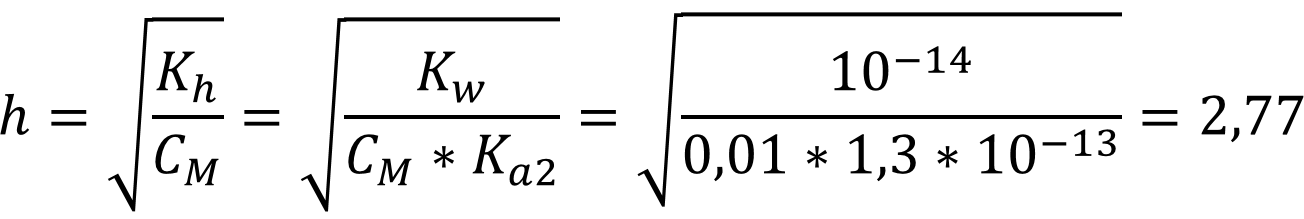
Ответ: h = 2,77 - таким образом, чем слабее кислота/основание тем сильнее происходит процесс гидролиза. Влияние величины концентрации видно по формуле, где концентрация обратно пропорциональна константе гидролиза. Влияние температуры можно отследить по изменению величин констант в зависимости от температуры.
Задача №3:
Рассчитайте степень гидролиза 0,01 M раствора сульфита аммония в воде, если для сернистой кислоты Ka1 = 1,3 * 10−2, Ka2 = 6,8 * 10−8, для аммиака Kb = 1,76 * 10−5, Kw = 1,0 * 10-14.
Дано:
Ka1
= 1,3 * 10−2
Ka2 = 6,8 *
10−8
Kb = 1,76 * 10−5
Kw = 1,0
* 10-14
CM = 0,01 моль/л
h - ?
Решение:
В
водном растворе сульфита аммония протекают следующие реакции:
H2O + H2O ↔ H3O+ +
OH-
(NH4)2SO3 + H2O ↔
2NH4+ + SO32-
SO32- + H2O ↔ OH- +
HSO3-
HSO3- + H2O ↔
OH- + H2SO3
Исходя из данных константа диссоциации по второй ступени на шесть порядков меньше первой, а значит и константа гидролиза будет значительно больше!!! При расчётах учитываем константу кислотности по второй ступени!!!
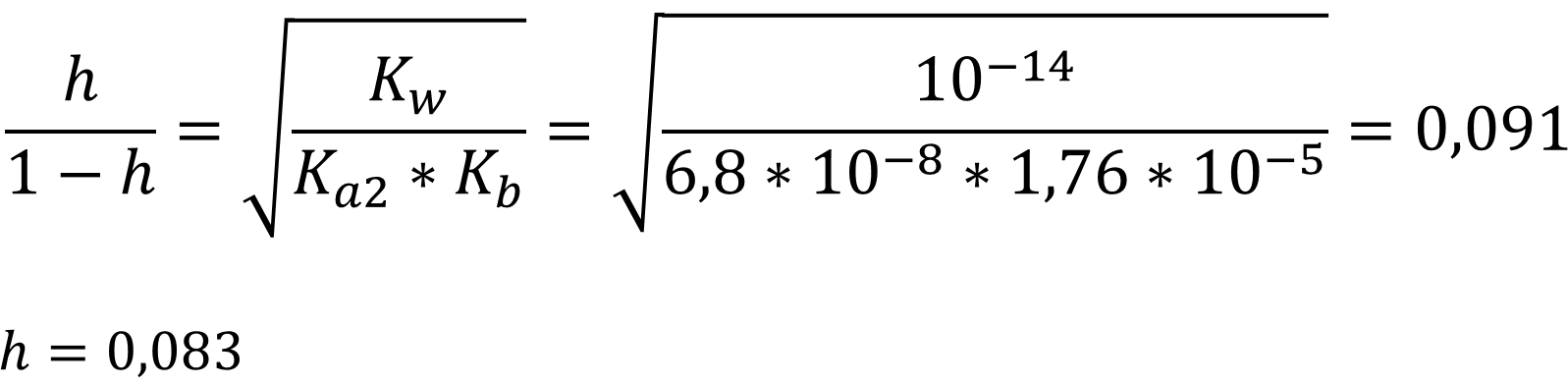
Ответ: h = 0,083 - степень гидролиза солей слабых кислот и слабых оснований не зависит от концентрации соли, а зависит только от силы кислот и оснований. Чем слабее кислоты и основания, тем сильнее процесс.

