Теория кислотно-основного титрования
Согласно протолитической теории Брёнстеда-Лоури кислотами называют вещества, способные отдавать протон, а основаниями – вещества, способные принимать протон. Общая схема протолитического взаимодействия:

С учётом влияния растворителя диссоциация кислоты/ основания описывается схемой:
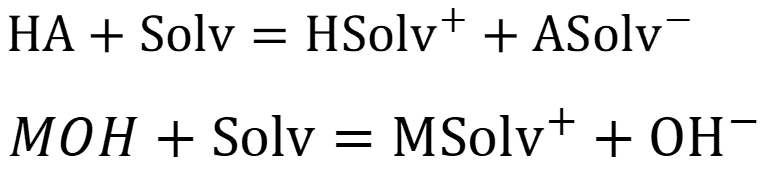
Константы равновесий рассчитываются по уравнениям:
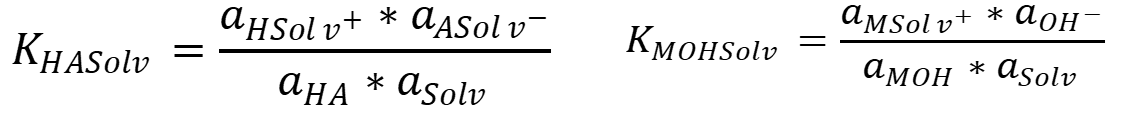
Различают три вида растворителей:
- Амфипротные – способны принимать и отдавать протоны
- Протофильные – способны только принимать протоны
- Апротонные – не способны реагировать с протоном
Автопротолиз амфипротного растворителя описывается схемой:
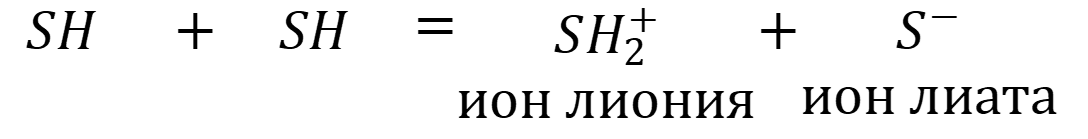
Константа автопротолиза растворителя рассчитывается по формуле:
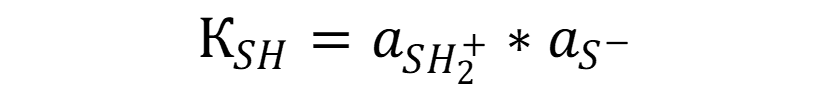
Сила кислот и оснований в любом растворителе описывается константами кислотности (a) и основности (b):
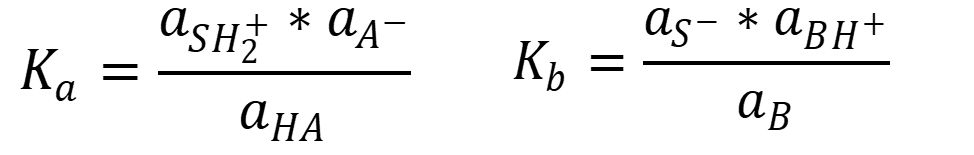
Между константами существует зависимость:
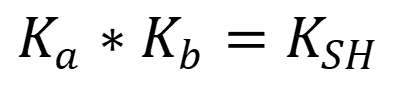
Растворитель влияет на силу кислот и оснований: сила кислоты увеличивается в основном растворителе, сила оснований увеличивается в кислотном растворителе.
Амфолиты – вещества, диссоциирующие в растворах и по типу кислоты и по типу основания. К таковым можно отнести:
- Кислые соли - гидрофосфаты, гидросульфиты;
- Основные соли - гидроксокарбонаты, гидроксосульфиты;
- Органические вещества содержащие кислотные и основные группы - аминокислоты, пептиды;
- Соли слабых кислот и слабых оснований - сульфит аммония, ацетат аммония...
Амфолиты образуют растворы с хорошими буферными свойствами. Благодаря способности к выборочной ионизации они противодействуют изменению pH при добавлении кислоты или основания. В присутствии кислот они принимают на себя протоны, удаляя последние из раствора, и противодействуют повышению его кислотности. При добавлении оснований амфолиты высвобождают ионы водорода в раствор, препятствуя возрастанию pH, и тем сохраняя его равновесие.
Буферные
системы – растворы, способные сохранять приблизительно постоянное значение рН,
при добавлении к ним небольших количеств сильных кислот и оснований. Буферные
растворы – смеси, состоящие из слабой кислоты и ее соли или слабого основания и
его соли. Кислотность буферных растворов почти не изменяется при их разбавлении
или при добавлении к ним некоторых количеств кислот или оснований.
Примером
буферной системы служит смесь растворов уксусной кислоты CH3COOH и её
натриевой соли CH3COONa. Эта соль как сильный электролит диссоциирует
практически нацело, т. е. даёт много ионов CH3COO-. При
добавлении к буферной системе сильной кислоты, дающей много ионов Н+,
эти ионы связываются ионами CH3COO- и образуют слабую (то
есть мало диссоциирующую) уксусную кислоту.
Кислотность (и, следовательно,
pH) буферной системы зависит от природы компонентов, их концентрации, а для
некоторых буферных систем и от температуры.
Для каждой буферной системы pH
остаётся примерно постоянным лишь до определённого предела, зависящего от
концентрации компонентов. Буфер имеет определенную «буферную емкость».
«Буферная емкость» - способность буферного раствора
оказывать сопротивление действию кислот или щелочей, вводимых в раствор в
одинаковых количествах и определенной концентрации. Если буферная емкость будет
исчерпана, то при прибавлении кислоты или основания рН буферного раствора резко
изменится. Буфер перестает быть буфером.
Практически допускается изменение рН
раствора на ± 1. Число эквивалентов N кислоты или основания, необходимое для
смещения рН одного литра буферного раствора на 1 единицу называется - буферной
емкостью. Буферная емкость раствора тем больше, чем больше концентрация
компонентов буфера. Буферное действие раствора прекращается, как только один из
компонентов раствора будет израсходован примерно на 90 %.
Буферные системы
широко используются в аналитической практике и в химическом производстве, так
как многие химические реакции идут в нужном направлении и с достаточной
скоростью лишь в узких пределах pH.
К кислотно-основным равновесиям относят так же процессы гидролиза. Гидролиз - это обменная реакция между ионами и молекулами воды, в результате которой образуются малодиссоциирующие молекулы и ионы. В результате процесса происходит выделение H3O+ или OH-, т.е. изменяется pH.
Степень
гидролиза — это отношение количества (концентрации) соли, которая вступает в
реакцию гидролиза, к общему количеству (концентрации) растворённой соли.
Степень гидролиза зависит от:
В целом процесс гидролиза обратим, но возможно протекание необратимого гидролиза, если выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут провзаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Метод
нейтрализации основан на проведении кислотно-основных (протолитических)
реакций. В ходе такого титрования меняется значение рН раствора.
Кислотно-основные реакции подходят для титриметрического анализа в наибольшей
степени: они протекают по строго определенным уравнениям, без побочных процессов
и с очень высокой скоростью. Для обнаружения конечной точки титрования (к.т.т.)
применяют кислотно-основные индикаторы. Можно использовать и инструментальные
методы, они особенно важны при титровании неводных, мутных или окрашенных
растворов, а также смесей нескольких веществ.
Метод нейтрализации
включает два варианта – ацидиметрию (титрант – раствор сильной кислоты) и
алкалиметрию (титрант – раствор сильного основания). Эти методы соответственно
применяют для определения оснований и кислот, в том числе ионных и
многопротонных. В ходе титрования сильных электролитов в водном растворе идет
реакция:
Титрование слабых кислот и слабых оснований в водных растворах соответствует схемам:
B + H3O+ → HB+ + H2O (ацидиметрия)
Рабочие растворы: HCl, HNO3, H2SO3; KOH, NaOH. Перед титрованием неустойчивые растворы стандартизуют по буре (кислоты) или по гидрофталату калия, бензойной кислоте, щавелевой кислоте (щёлочи).
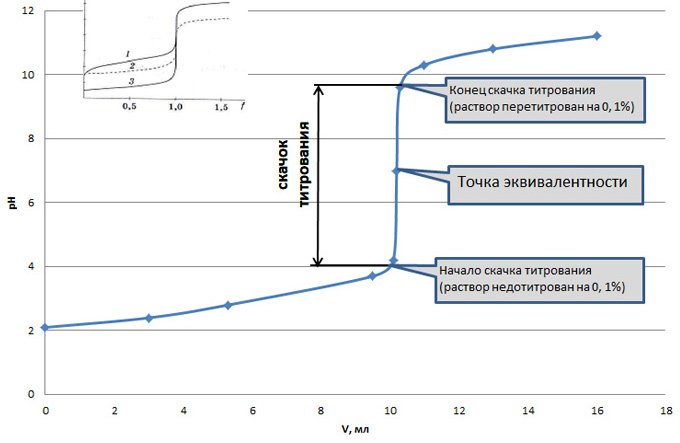
Кривая титрования - графическая зависимость изменения рН титруемого раствора от объема добавленного титранта, или от степени оттитрованности (f), показывает визуально ход титрования. Скачок титрования соответствует точке эквивалентности, высота скачка зависит от концентрации титруемого электролита и его природы - скачок тем больше, чем сильнее электролит и чем больше его концентрация (1, 2, 3 на рисунке - различные концетрации и силы электролитов).
Для
обнаружения к.т.т. в методе нейтрализации используют кислотно-основные индикаторы – синтетические
органические красители, являющиеся слабыми кислотами или основаниями и меняющие
видимую окраску в зависимости от рН раствора. Важнейшими характеристиками
каждого индикатора являются интервал перехода окраски и показатель титрования
(pT). Интервал перехода – это зона между двумя
значениями рН, внутри которой наблюдается смешанная окраска индикатора.
Показатель титрования рТ - это значение рН, при
котором переход окраски индикатора наблюдается особенно резко.
Зная
характеристики разных индикаторов, можно теоретически обоснованно подбирать их,
чтобы получить правильные результаты анализа. Придерживаются следующего правила:
"интервал перехода окраски индикатора должен лежать в области скачка на кривой
титрования". Для этого необходимо рассчитать границы скачка и выбрать
соответствующий индикатор. Можно выбирать индикатор и без расчетов границ скачка
титрования. Для этого вычисляют теоретическое значение рН в т.э. и выбирают
индикатор с примерно таким же значением рТ.
Основные определения:
-
Титриметрический анализ (титрование) — метод количественного/массового анализа в аналитической химии, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом;
-
Титрант — реагент с точно известным концентрацией, добавляемый к исследуемому раствору для количественного анализа содержащихся в нем веществ или их элементов (ионов, функциональных групп);
-
Аликвота – это точно известная часть раствора, взятая для анализа градуированной или мерной пипеткой и помещённая в колбу для титрования;
-
Точка эквивалентности - момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце;
-
Конечная точка титрования — это момент титрования, когда индикатор меняет цвет, сигнализируя о том, что к анализируемому веществу было добавлено достаточное количество титранта для достижения желаемого уровня реакции. Разница между конечной точкой и точкой эквивалентности заключается в том, что наблюдаемое изменение цвета индикатора определяет конечную точку. Напротив, точка эквивалентности представляет собой точную стехиометрическую нейтрализацию аналита титрантом;
-
Индикатор - вещество, меняющее свою окраску при изменении рН среды;
-
Крива́я титрова́ния — графическое изображение зависимости определяемой в ходе титрования величины от объёма добавленного стандартного раствора титранта или степени оттитрованности;
-
Скачок титрования - участок кривой титрования, соответствующий резкому изменению свойств системы (в случае кислотно-основного титрования - резкому изменению рН) вблизи точки эквивалентности (обычно в интервале значений степени оттитрованности 0,999 - 1,001);
-
Степень оттитрованности - отношение количества оттитрованного вещества к его исходному количеству в анализируемом растворе;
-
Стандартный раствор – это раствор, который содержит определенное количество вещества в единице объема или массы;
-
Стандартизация раствора – это процесс установления точной концентрации раствора определенного вещества, который будет использоваться в лаборатории для анализа;
-
Интервал перехода – это зона между двумя значениями рН, внутри которой наблюдается смешанная окраска индикатора;
-
Показатель титрования (рТ) - это значение рН, при котором переход окраски индикатора наблюдается особенно резко.
-
Прямое титрование - титрование при котором к раствору определяемого вещества добавляют небольшими порциями раствор титранта.
-
Обратное титрование - титрование при котором к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют его остаток, не вступивший в реакцию. Приём обратного титрования используется, если скорость реакции мала, не удается подобрать индикатор или наблюдаются побочные эффекты (например, потери определяемого вещества вследствие летучести).
-
Заместительное титрование - титрование при котором проводят стехиометрическую реакцию определяемого вещества со вспомогательным реагентом, а получающийся в эквивалентном количестве продукт оттитровывают подходящим титрантом. Титрование заместителя используют, если реакция нестехиометрична или протекает медленно.
-
Способ пипетирования - титрование разных аликвот, отбираемых пипеткой из мерной колбы определенного объема, в которой растворена навеска анализируемого вещества. Из результатов параллельных титрований находят среднее арифметическое значение и используют для вычисления массы определяемого вещества.
-
Способ отдельных навесок - титрование некоторого числа навесок вещества, взятых на аналитических весах, растворённых в небольших объемах растворителя.

