Равновесие осадок-раствор/осадительное титрование
Ионные равновесия, связанные с осаждением и образованием осадков, являются обратимыми и характеризуются константой равновесия – произведением растворимости (ПР):
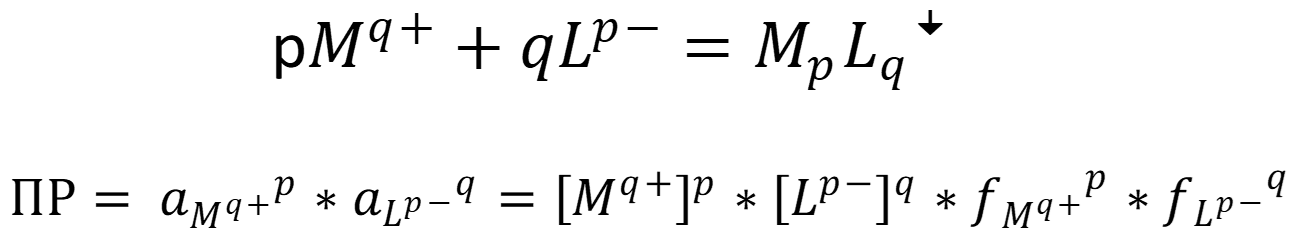
В отсутствие сторонних ионов, так как концентрации ионов осадка малы, используют равновесные концентрации:
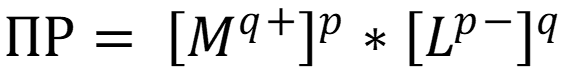
Растворение осадка происходит, если в растворе над осадком произведение активностей/концентраций ионов станет меньше величины ПРT (справочные данные).
Растворимость малорастворимого вещества - молярная концентрация вещества в насыщенном растворе. Для малорастворимых веществ имеется взаимосвязь произведения растворимости и растворимости:
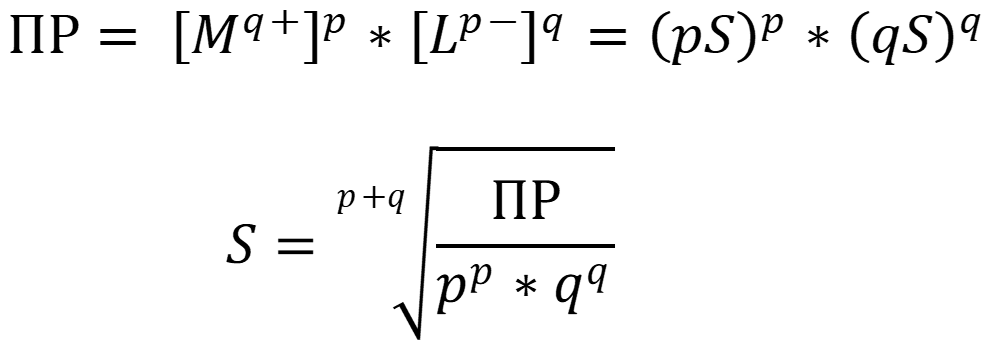
- "Солевой эффект" - снижение активности ионов, в следствие
взаимодействия с ионами раствора. Для учёта влияния «солевого эффекта», в
случае присутствия сторонних ионов вместо равновесной концентрации
используют активность ионов:

- "Эффект одноимённого иона" - в присутствии избытка
одноимённых ионов в растворе растворимость осадка падает, однако очень большой
избыток может дать рост растворимости осадка за счёт роста ионной силы или за
счёт процессов комплексообразования:
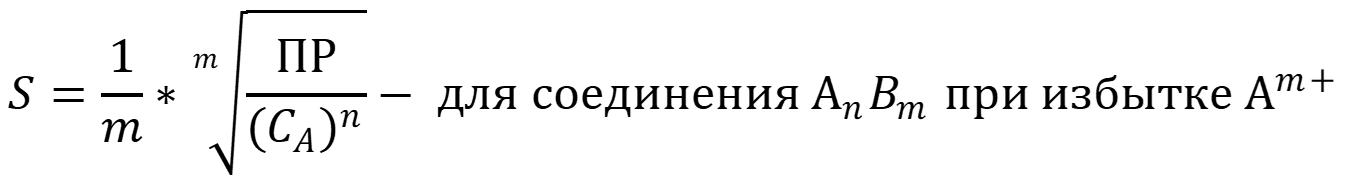
- Гидролиз - процесс гидролиза уменьшает концентрацию ионов
осадка в растворе, что в итоге вызывает растворение осадка до наступления
равновесия, расчёт растворимости в таких условиях ведётся с учётом количества
гидролизованных ионов, также следует помнить о глубине
гидролиза!:
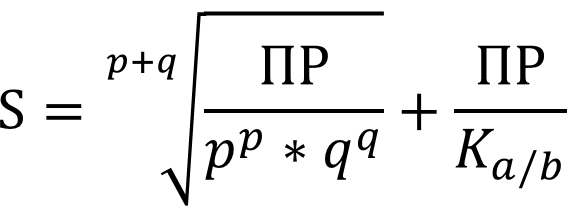
- pH - является существенным условием при расчёте
растворимости, так как:
- OH--ионы достаточно популярный осадитель;
- от pH зависит сила гидролиза ионов входящих в состав осадка;
- многие ионы образуют комплексные соединения с OH-;
- от pH зависит мольная доля иона осадка в растворе (слабые кислоты).
В каждом случае расчёт ведётся с учётом мольной доли ионов осадка в растворе, т.е. расчитывается условное ПР:
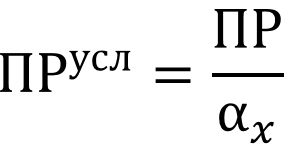
- Комплексообразование - часто используется для маскирования ионов примесей в растворе. В каждом случае расчёт ведётся с учётом мольной доли ионов осадка в растворе, т.е. расчитывается условное ПР.
Метод осадительного титрования основан на проведении реакций осаждения. В ходе такого титрования осаждается определяемый ион из раствора, после полного осаждения которого происходит реакция индикатора с ионами раствора или осадком. Для обнаружения конечной точки титрования (к.т.т.) применяют различные индикаторы, зависящие от применяемого метода. Возможно использовать и инструментальные методы, они особенно важны при титровании неводных, мутных или окрашенных растворов, а также смесей нескольких веществ.
Требования, предъявляемые к реакциям осадительного титрования:
- Реакции должны протекать строго стехиометрически в соответствии с уравнением реакции. Удовлетворительны с этой точки зрения реакции осаждения галогенидов и тиоцианата серебра (аргентометрия), а также ряда соединений ртути (I).
- Реакции должны протекать практически до конца с количественным образованием осадка не менее, чем на 99,99%. Используют осадки, у которых ПР ≤ 1 * 10-8.
- Осадок должен выпадать быстро, при комнатной температуре.
- Должны отсутствовать побочные реакции и процессы соосаждения титранта или определяемого вещества с образующимся осадком.
- Должны существовать способы фиксирования точки эквивалентности.
Метод осадительного титрования включает в себя несколько вариантов:
Метод основан на образовании малорастворимых осадков галогенидов серебра. Титрантом является AgNO3. Различают несколько способов:
- Метод МОРА - прямое титрование галогенидов с K2CrO4, образующим с титрантом в к.т.т. кирпично-красный осадок Ag2CrO4. Соблюдать концентрацию хромата в растворе обязательно, так как это может повлиять на последовательность выпадения осадков! Титрование проводят в нейтральной или слабощелочной среде, из-за побочных реакций образования иона-бихромата в кислом растворе и образования осадка оксида серебра в сильно щелочной среде! Из-за соосаждения с хроматом серебра метод не используют для определения иодид- и тиоцианат-ионов! Определению мешают ионы образующие малорастворимые соединения с ионами серебра;
- Метод Фольгарда - метод обратного титрования при котором к анализируемому раствору добавляют избыток нитрата серебра, остаток которого после реакции оттитровывают роданидом аммония или калия. Индикатором являются железо-аммонийные квасцы, Fe3+ из которых образует кроваво-красное соединение с ионом SCN-. Титрование проводят в кислой среде для предотвращения гидролиза иоинов железа с образованием осадка Fe(OH)3. Определению мешают ионы окисляющие SCN- и F-, образующий прочный комплекс с Fe3+;
- Метод Фаянса - прямое титрование галогенид-, цианид-, тиоцианат-ионов раствором нитрата серебра в присудствии адсорбционных индикаторов. Адсорбция индикатора (Флуоресцеин, эозин) происходит только после того как полностью оттитруется определяемый ион, окрашивая осадок в розовый (Ф) или красно-фиолетовый (Э) цвет. pH титрования зависит от индикатора (Ф. 6,5 - 10,3; Э. 2 - 6).
Метод основан на образовании малорастворимых осадков хлорида и иодида с Hg22+. Более чувствителен чем аргентометрия из-за большей величины ПР, но соединения ртути токсичны!
Метод основан на использовании реакции образования малорастворимых ферроцианидов d-элементов. Титрование проводят в присутствии индикаторов, выбор которых зависит от определяемого элемента. В ТЭ наблюдается изменение окраски раствора!
Прямое титрование ионов образующих малорастворимые сульфаты с металлохромными индикаторами.
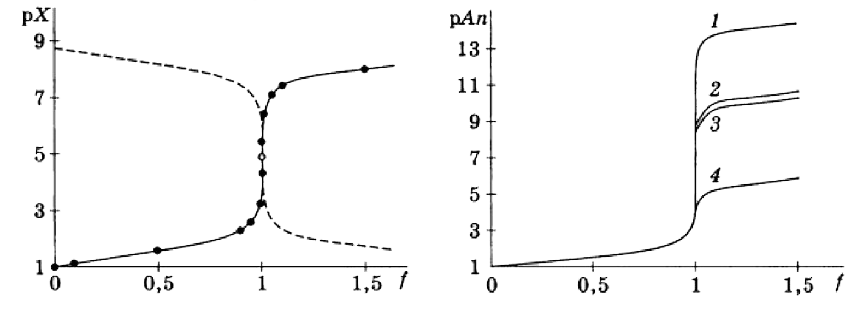
Кривая титрования - графическая зависимость изменения показателя концентрации титруемого иона от объема добавленного титранта, или от степени оттитрованности (f), показывает визуально ход титрования. Скачок титрования соответствует точке эквивалентности, высота скачка зависит от концентрации титруемого иона и величины ПР осадка - скачок тем больше, чем меньше величина ПР и чем больше его концентрация (1, 2, 3 и 4 на рисунке - различные величины ПР).
Основные определения:
-
Титриметрический анализ (титрование) — метод количественного/массового анализа в аналитической химии, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом;
-
Титрант — реагент с точно известным концентрацией, добавляемый к исследуемому раствору для количественного анализа содержащихся в нем веществ или их элементов (ионов, функциональных групп);
-
Аликвота – это точно известная часть раствора, взятая для анализа градуированной или мерной пипеткой и помещённая в колбу для титрования;
-
Точка эквивалентности - момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце;
-
Конечная точка титрования — это момент титрования, когда индикатор меняет цвет, сигнализируя о том, что к анализируемому веществу было добавлено достаточное количество титранта для достижения желаемого уровня реакции. Разница между конечной точкой и точкой эквивалентности заключается в том, что наблюдаемое изменение цвета индикатора определяет конечную точку. Напротив, точка эквивалентности представляет собой точную стехиометрическую нейтрализацию аналита титрантом;
-
Индикатор - вещество, меняющее свою окраску и форму при полной оттитровке определяемого иона;
-
Крива́я титрова́ния — графическое изображение зависимости определяемой в ходе титрования величины от объёма добавленного стандартного раствора титранта или степени оттитрованности;
-
Скачок титрования - участок кривой титрования, соответствующий резкому изменению свойств системы (в случае кислотно-основного титрования - резкому изменению рН) вблизи точки эквивалентности (обычно в интервале значений степени оттитрованности 0,999 - 1,001);
-
Степень оттитрованности - отношение количества оттитрованного вещества к его исходному количеству в анализируемом растворе;
-
Стандартный раствор – это раствор, который содержит определенное количество вещества в единице объема или массы;
-
Стандартизация раствора – это процесс установления точной концентрации раствора определенного вещества, который будет использоваться в лаборатории для анализа;
-
Прямое титрование - титрование при котором к раствору определяемого вещества добавляют небольшими порциями раствор титранта.
-
Обратное титрование - титрование при котором к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют его остаток, не вступивший в реакцию. Приём обратного титрования используется, если скорость реакции мала, не удается подобрать индикатор или наблюдаются побочные эффекты (например, потери определяемого вещества вследствие летучести).
-
Заместительное титрование - титрование при котором проводят стехиометрическую реакцию определяемого вещества со вспомогательным реагентом, а получающийся в эквивалентном количестве продукт оттитровывают подходящим титрантом. Титрование заместителя используют, если реакция нестехиометрична или протекает медленно.
-
Способ пипетирования - титрование разных аликвот, отбираемых пипеткой из мерной колбы определенного объема, в которой растворена навеска анализируемого вещества. Из результатов параллельных титрований находят среднее арифметическое значение и используют для вычисления массы определяемого вещества.
-
Способ отдельных навесок - титрование некоторого числа навесок вещества, взятых на аналитических весах, растворённых в небольших объемах растворителя.

