Титриметрический анализ
Метод анализа, основанный на точном измерении количества реактива, израсходованного на реакцию с определяемым веществом. Момент титрования, когда количество вещества добавленного титранта химически эквивалентно титруемому веществу, называется точкой эквивалентности (ТЭ). ТЭ не всегда совпадает с конечной точкой титрования (КТТ) из-за индикаторных ошибок.
Требования к реакциям применяемым в титриметрии:
- Количественное протекание
- Большая скорость
- Отсутствие побочных процессов
- Возможность индикации окончания реакции
Закон эквивалентов: все вещества реагируют и образуются в эквивалентных отношениях (количествах γ).
Математически выражается:

В титриметрическом анализе используется следствие из закона эквивалентов:
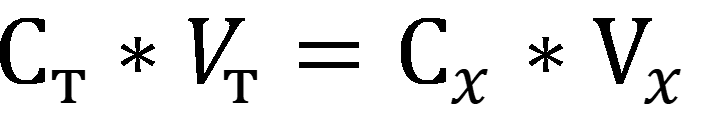
где С – нормальная концентрация вещества.
Классификация:
По типу реакции:
- Кислотно-основное титрование
- Осадительное титрование
- Комплексометрическое титрование
- Окислительно-восстановительное титрование
По способу проведения:
- Прямое титрование
- Обратное титрование
- Заместительное титрование
По методу проведения:
- Метод отдельных навесок – титрование точно известной массы определяемого вещества
- Метод пипетирования – титрование точно известного объёма раствора

