Расчёт pH амфолитов
Амфолиты – вещества, диссоциирующие в растворах и по типу кислоты и по типу основания. К таковым можно отнести:
- Кислые соли - гидрофосфаты, гидросульфиты;
- Основные соли - гидроксокарбонаты, гидроксосульфиты;
- Органические вещества содержащие кислотные и основные группы - аминокислоты, пептиды;
- Соли слабых кислот и слабых оснований - сульфит аммония, ацетат аммония...
В водных растворах амфолитов верно равенство:
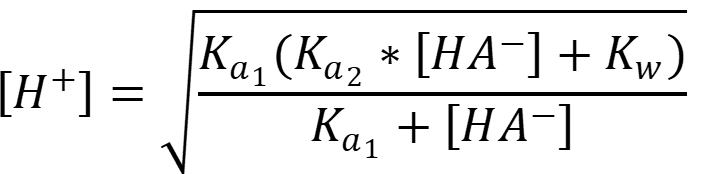
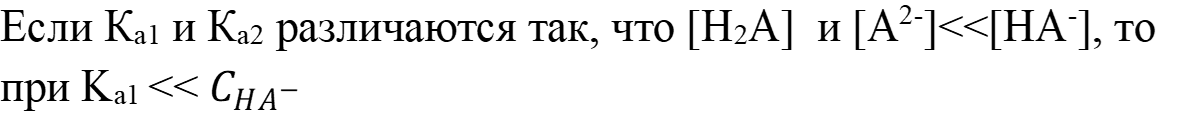
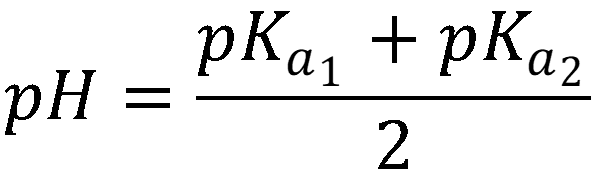
Задача №1:
Рассчитать
рН 0,0100 М водного раствора ацетата аммония, если:
pKа (ук. к-ты)
= 4,76; pKа (аммиака) = 9,24.
Дано:
pKа
(ук. к-ты) = 4,76
pKа (аммиака) = 9,24
Ссоли =
0,0100 М
pH - ?
Решение:
Так как константа диссоциации существенно меньше величины концентрации, то используем формулу:
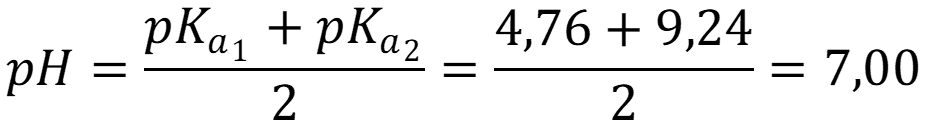
Ответ: рН = 7,00
Рассчитаем pH раствора в случае когда
автопротолиз воды существеннен
Задача №2:
Рассчитать
рН 0,0001 М водного раствора ацетата аммония, если:
pKа (ук. к-ты)
= 4,76; pKа (аммиака) = 9,24.
Дано:
pKа
(ук. к-ты) = 4,76
pKа (аммиака) = 9,24
Ссоли =
0,0001 М
pH - ?
Решение:
Так как константа диссоциации сравнима с величиной концентрации и пренебрегать автопротолизом воды нельзя, то используем формулу:
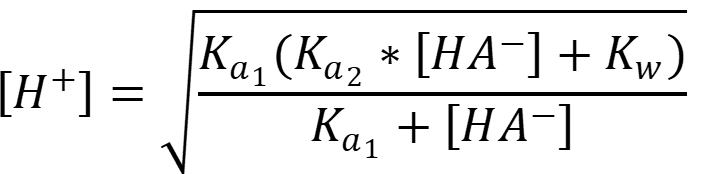
В данном случае Ка1 - константа кислотности уксусной кислоты, Ка2 - костанта кислотности катиона аммония, диссоциация которого даёт избыток гидроксил-ионов и равна 14 - pKb, [HA-] равна концентрации соли, так как соль полностью диссоциирует в растворе:
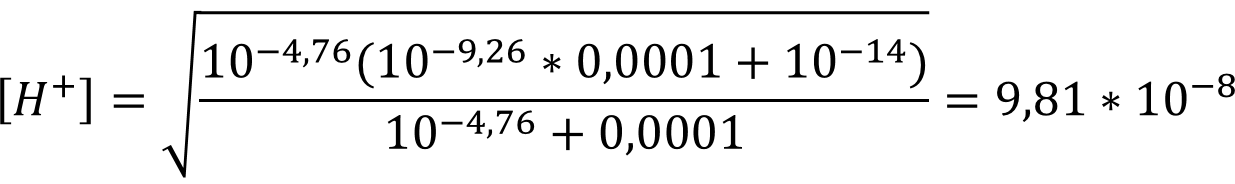
pH = - lg (9,81 * 10-8) = 7,01
Ответ: рН = 7,01
Таким образом pH солей образованных
слабыми кислотами и слабыми основаниями не зависит от концентрации!!!
Задача №3:
Рассчитать рН 0,100 M и 0,0001 М водных растворов гидрофосфата и дигидрофосфата натрия.
Дано:
Справочные
данные:
Kа1 = 7,08 * 10-3
Kа2 = 6,17 *
10-8
Kа3 = 4,68 * 10-13
Ссоли1
= 0,1000 М
Ссоли2 = 0,0001 М
pH - ?
Решение:
При концентрации 0,1 М создаются все условия для расчёта pH по упрощённой формуле, так как в растворе дигидрофосфат диссоциирует на ионы Na+ и H2PO4-, то используются Kа1 и Kа2:
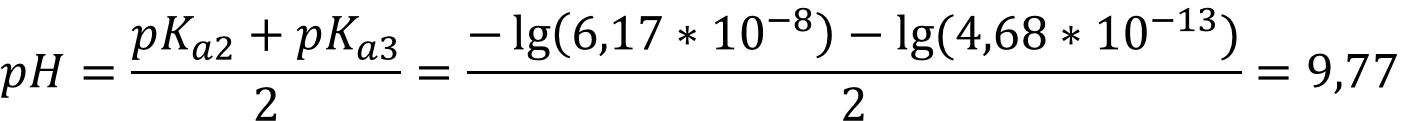
При концентрации 0,0001 М необходимо учитывать автопротолиз воды, для раствора дигидрофосфата натрия формула приобретает вид:
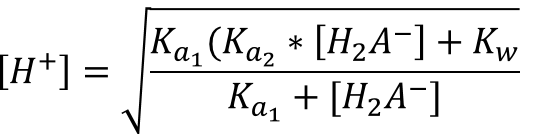
В данном случае [H2PO3-] равна концентрации соли:
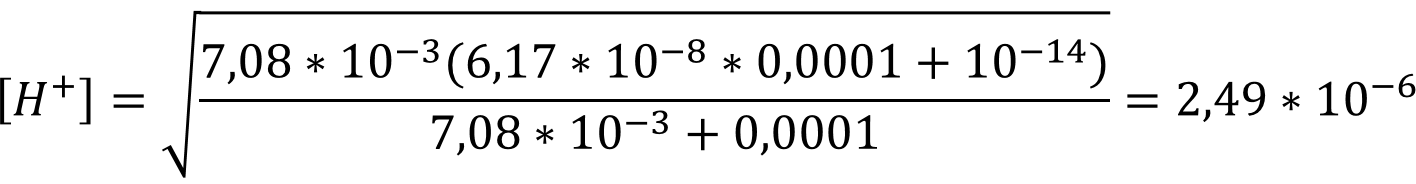
pH = - lg (2,49 * 10-6) = 5,60
Для раствора гидрофосфата диссоциация происходит на ионы Na+ и HPO42- и используются Kа2 и Kа3:
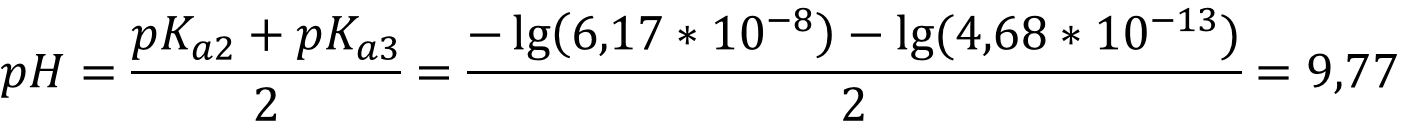
При концентрации 0,0001 М необходимо учитывать автопротолиз воды, для раствора гидрофосфата натрия формула приобретает вид:
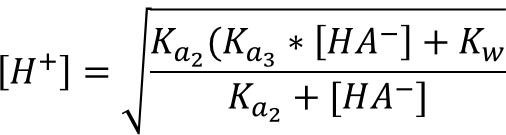
В данном случае [HPO42-] равна концентрации соли:
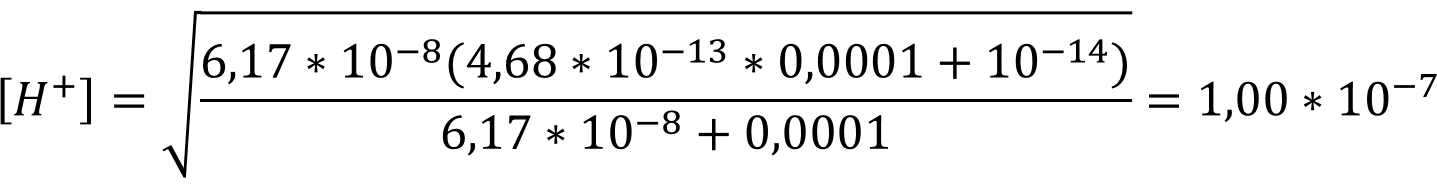
pH = - lg (1,00 * 10-7) = 7,00
Ответ: Для дигидрофосфата: при С = 0,1 М pH = 4,74; при С =
0,0001 М pH = 5,60
Для гидрофосфата: при С = 0,1 М pH = 9,77; при С = 0,0001
М pH = 7,00
Таким образом pH кислых солей существенно зависит от
концентрации!!!

