Расчёт pH растворов слабых электролитов
В водных растворах слабых электролитов:
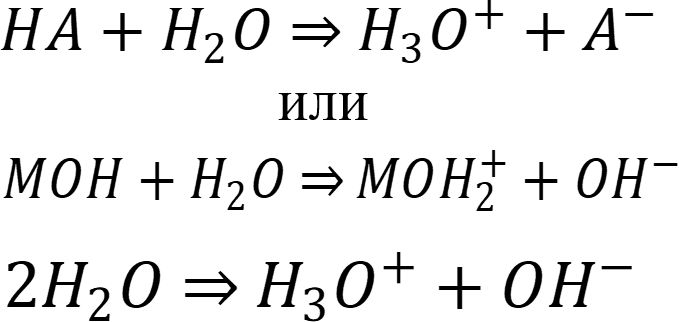
При расчётах необходимо учитывать условия равновесия. На величину рН влияют степень диссоциации электролита, концентрация электролита, автопротолиз воды.
- Для слабых электролитов со степенью диссоциации α < 5% pH вычисляется по формулам:
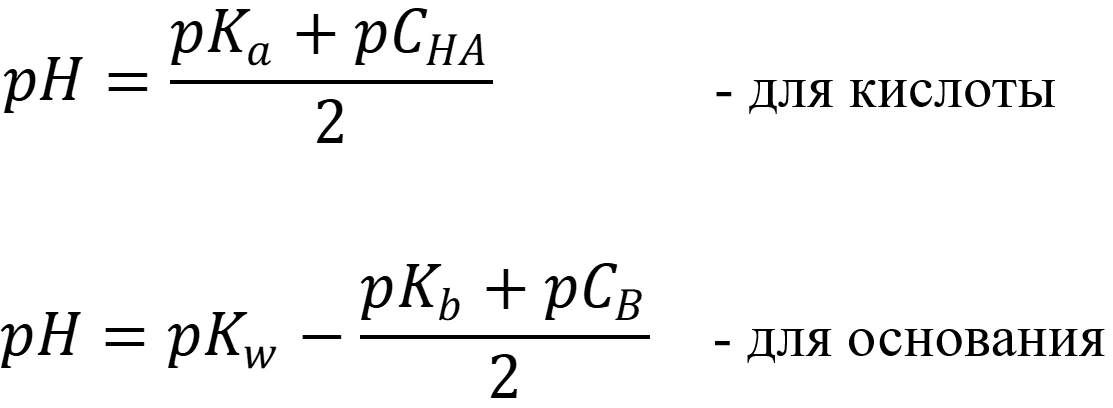
Задача №1:
Рассчитать рН 0,5 М раствора пропионовой кислоты, если Кд = 1,4 * 10-5.
Дано:
Кд
= 1,4 * 10-5
Ск = 0,5 М
pH - ?
Решение:
Рассчитаем степень диссоциации электролита:
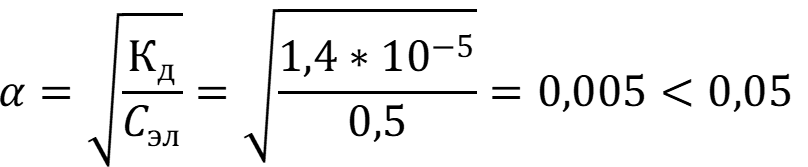
Степень диссоциации меньше 5%, рН вычисляем по формуле:
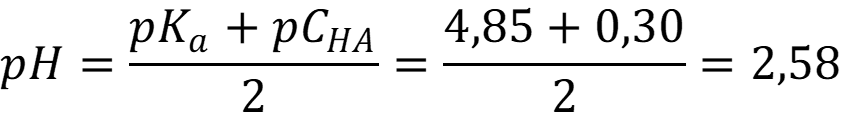
Ответ: рН = 2,58.
- Для слабых электролитов с α > 5% верны равенства:
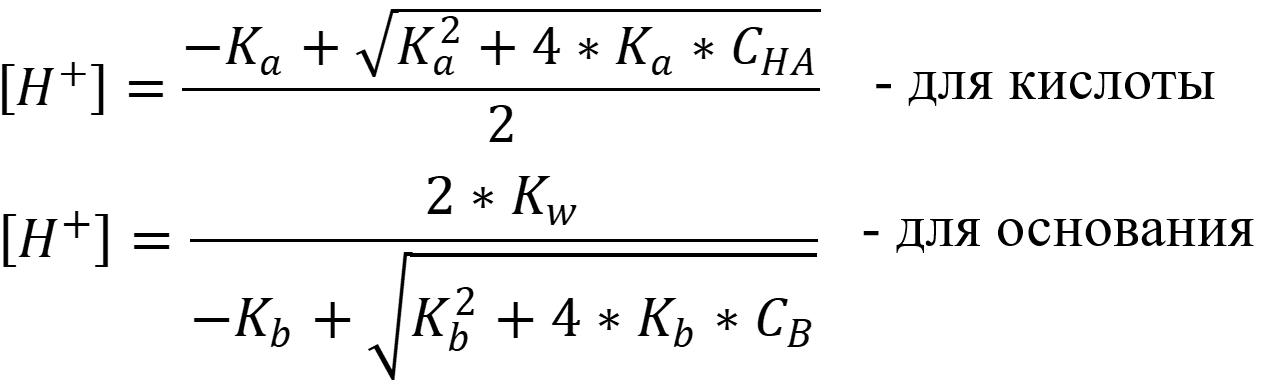
Задача №2:
Рассчитать рН 0,001 М раствора аммиака, если Кb = 1,79 * 10-5.
Дано:
Кb
= 1,79 * 10-5
Сосн = 0,001 М
pH - ?
Решение:
Рассчитаем степень диссоциации аммиака в растворе:

Степень диссоциации больше 5%, аммиак - основание, используем формулу:
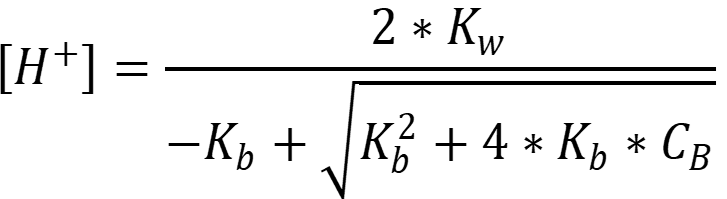
Рассчитаем концентрацию ионов водорода:
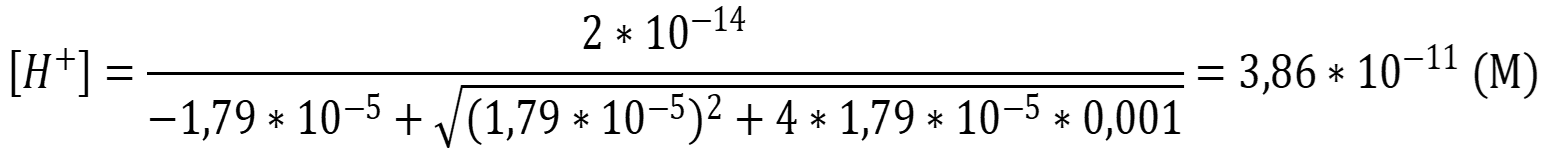
Рассчитаем рН раствора:
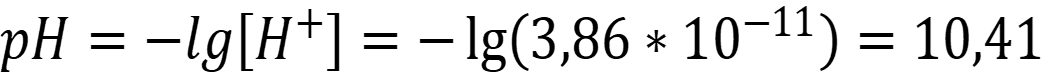
Ответ: рН = 10,41
- В водных растворах слабых электролитов с Kдисс < 10-8 и С < 10-4 моль/л необходимо учитывать автопротолиз воды:
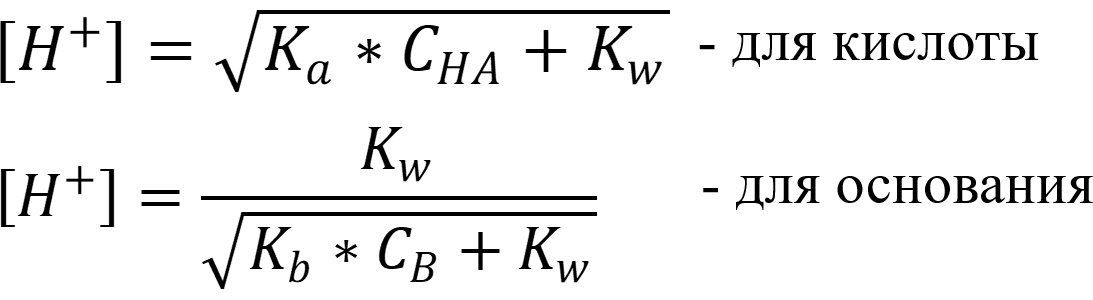
Задача №3:
Рассчитать рН раствора анилина в воде концентрацией равной 1,00 * 10-5 моль/л, если Кb = 3,79 * 10-10
Дано:
Кb
= 3,79 * 10-10
Сан = 1,00 * 10-5
моль/л
pH - ?
Решение:
Анилин – очень слабое основание с низким значением константы диссоциации, при расчетах необходимо учитывать автопротолиз воды. Расчитаем концентрацию ионов водорода:
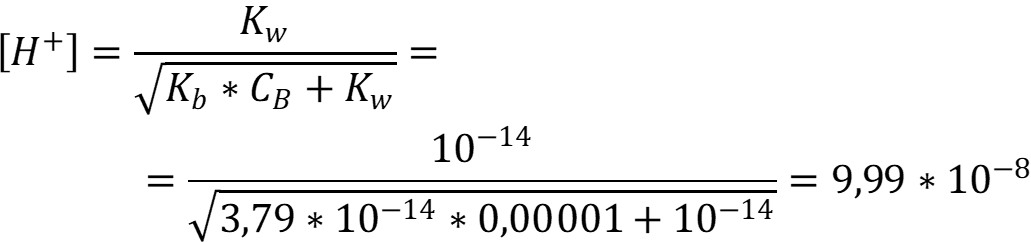
Рассчитаем рН раствора анилина:
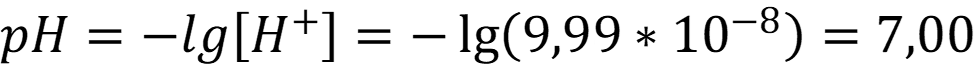
Ответ: рН = 7,00 - как видно по расчёту в данных условиях вода нивелирует присутствие основания собственной ионизацией.

