Расчёт pH сильных электролитов
Сильные кислоты и основания в водных растворах практически полностью диссоциированы в водных растворах, но в результате межионных взаимодействий действительная концентрация несколько меньше и равна активности.

В
очень разбавленных растворах активность равна концентрации.
В разбавленном
растворе кислоты проходит реакция:
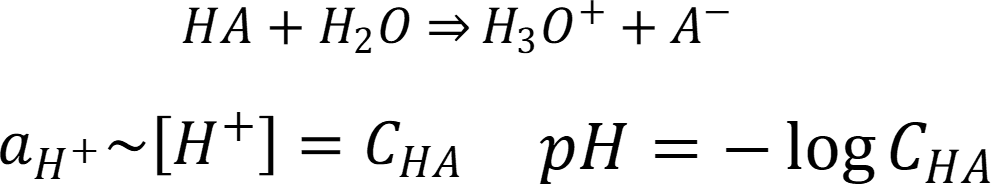
Для разбавленного раствора основания:
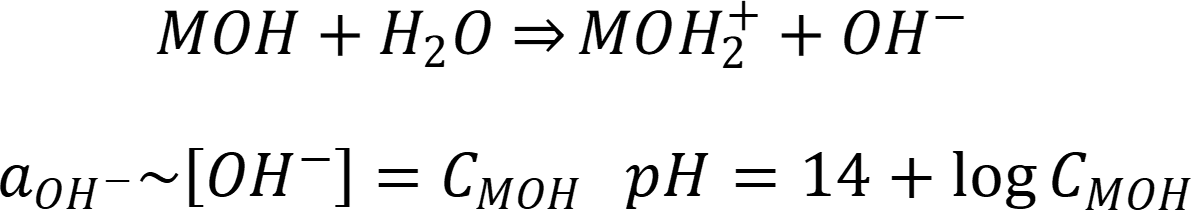
Задача №1:
Вычислить pH 0,1000 М раствора азотной кислоты с учётом и без учёта ионной силы раствора.
Дано:
СHA
= 0,1000 моль/л
pH - ?
Решение:
Рассчитаем pH раствора без учёта ионной силы раствора:
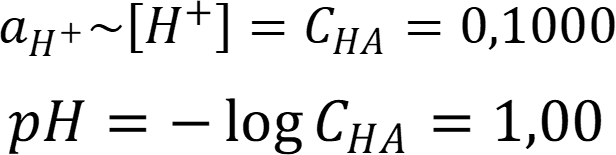
Рассчитаем ионную силу раствора азотной кислоты:
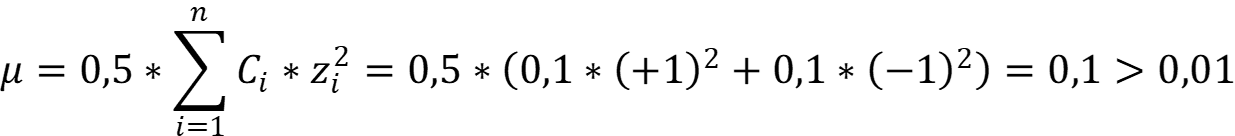
Рассчитаем коэффициент активности иона водорода:
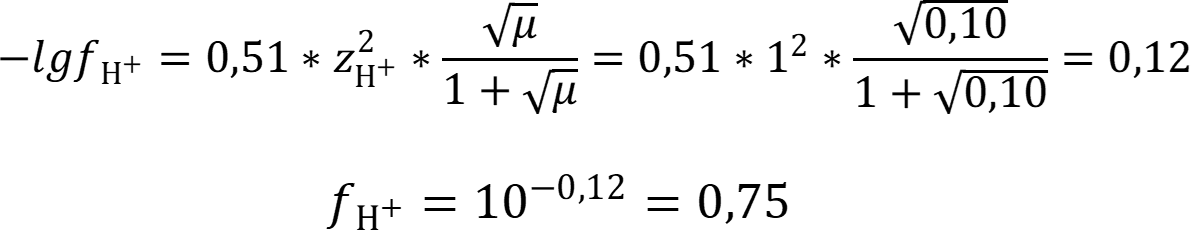
Рассчитаем рН раствора с учётом ионной силы:
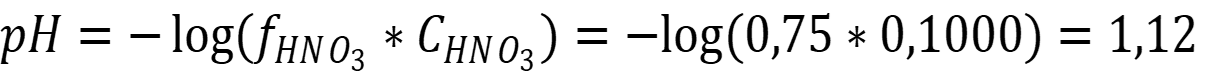
Ответ: рН = 1,12 - как видно при ионной силе более 0,01 влияние сторонних процессов весьма велико, в данном случае 12%. И если не оговорено в условиях задачи, расчёт активности обязателен. При ионной силе менее 0,01 учитывать сторонние процессы не обязательно, так как их вклад в пределах погрешности измерений.
При концентрации кислоты/основания меньше 10-4 М необходимо дополнительно учитывать автопротолиз воды, как растворителя с собственной ионизацией.
- Для кислоты
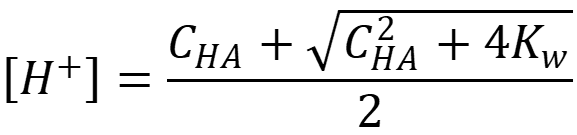
- Для основания
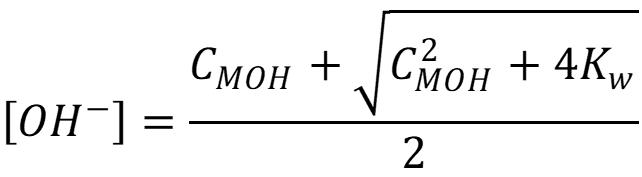
Задача №2:
Рассчитать pH раствора едкого натра концентрацией 1,0 * 10-6 М
Дано:
СMOH
= 1,0 * 10-6 M
pH - ?
Решение:
Так как концентрация основания меньше 10-4 М то расчёт pH необходимо рассчитывать с учётом автопротолиза воды:
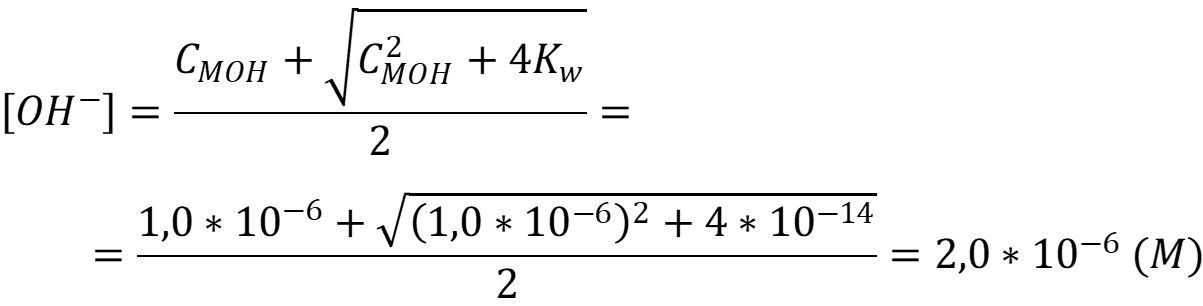
Рассчитаем pH раствора:
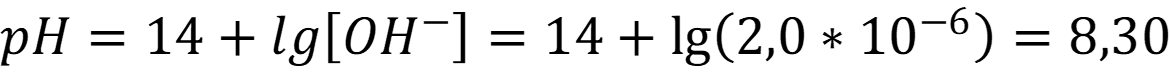
При расчёте без учёта автопротолиза воды:
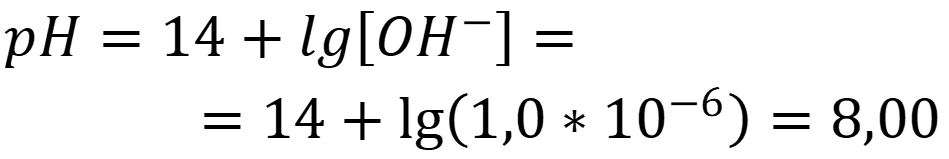
Ответ: рН = 8,30 - Таким образом при расчёте pH сильных электролитов следует учитывать:
- при высоких концентрациях - ионную силу раствора
- при низких концентрациях - собственную ионизацию растворителя

