Расчёт равновесной концентрации иона металла
В общем виде комплексообразование в растворе описывается суммарным уравнением:
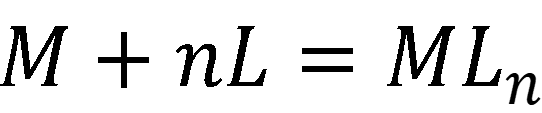
Константа равновесия называется константой устойчивости:
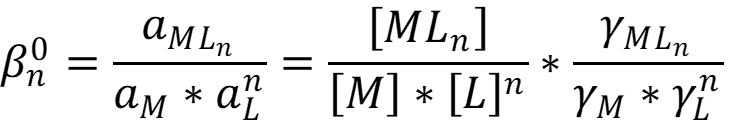
Суммарная константа устойчивости является произведением ступенчатых констант для каждой ступени образования:

Задача:
Рассчитать концентрацию ионов серебра в растворе, где равновесная концентрация молекул аммиака равна 0,10 моль/л, а общая концентрация серебра – 0,0010 моль/л.
Дано:
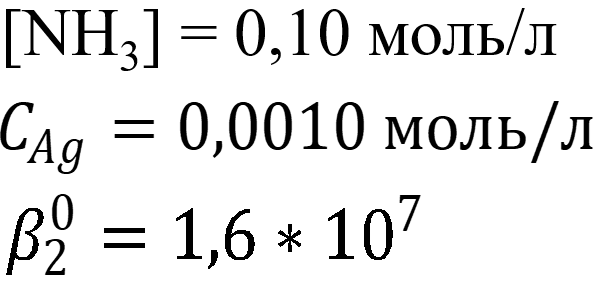
Решение:
Известно, что аммиак связывает серебро в комплекс состава 1 : 2, без учёта ступенчатости:
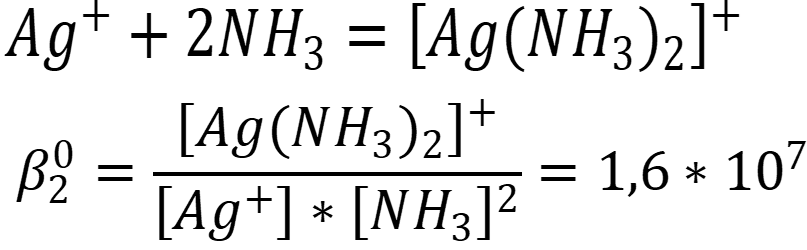
Примем [Ag+] = x, равновесную концентрацию комплекса [Ag(NH3)2]+ выразим из уравнения материального баланса:
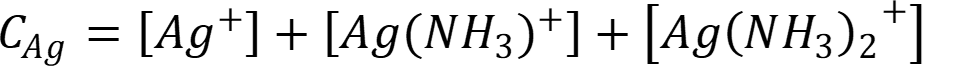
Концентрация неустойчивого комплекса 1:1 незначительна:
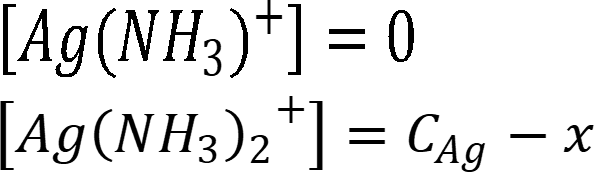
Подставим данные в уравнение константы устойчивости:
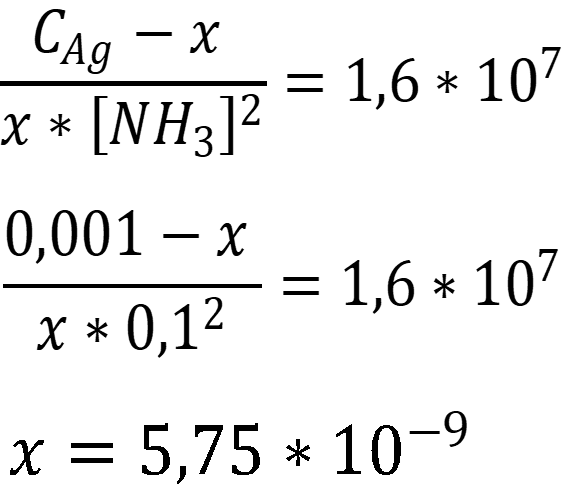
Ответ: [Ag+] = 5,8 * 10-9 моль/л.

