Расчёт произведения растворимости осадка
Ионные равновесия, связанные с осаждением и образованием осадков, являются обратимыми и характеризуются константой равновесия – произведением растворимости (ПР):
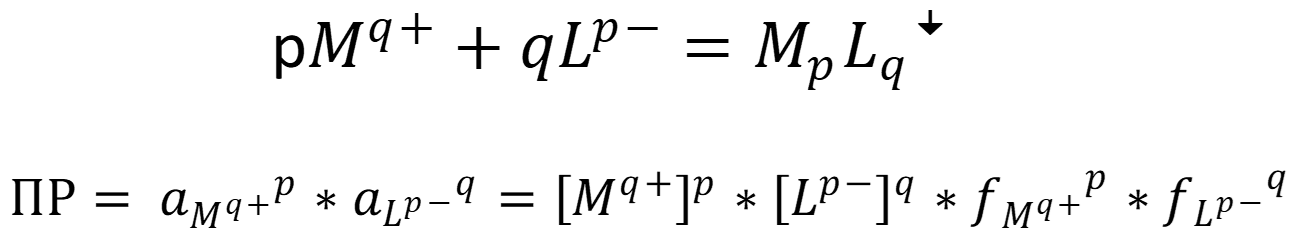
В отсутствие сторонних ионов, так как концентрации ионов малы, используют равновесные концентрации или растворимость:
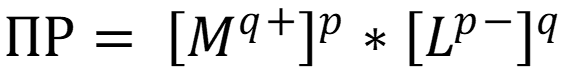
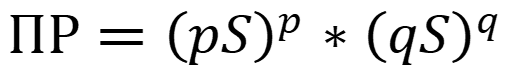
Для учёта влияния «солевого эффекта» вместо концентрации используют активность ионов:

Задача:
Вычислить произведение растворимости осадка хромата серебра, если в 500,0 мл воды растворяется 0,011 г осадка. Растворится ли 0,5000 г осадка в 500,0 мл 1,00 М раствора хлорида натрия?
Дано:
Vводы
= 0,5000 л
Vр-ра = 0,5000 л
mос = 0,5000
г
Ср-ра = 1,00 М
Sос = 0,022 г/л
ПРос
- ?
Решение:
Растворение осадка происходит по уравнению реакции:
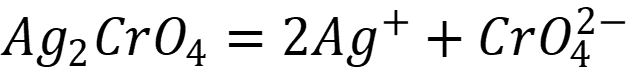
Так как концентрация ионов мала, ионной силой раствора можно пренебречь:
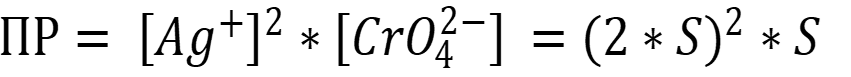
Пересчитаем растворимость на моль/л:
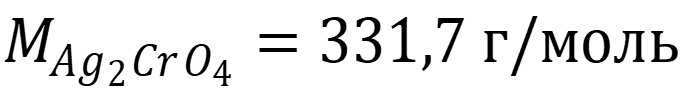
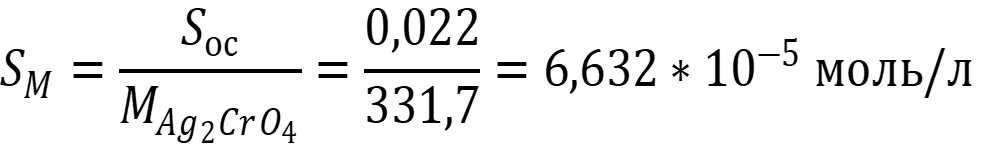
Рассчитаем ПР по формуле:
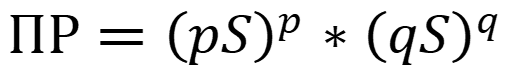
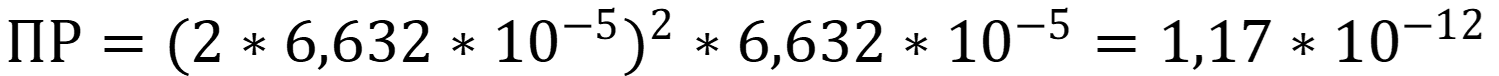
Для того, чтобы определить, растворится ли осадок в растворе соли, необходимо рассчитать произведение активностей ионов хромата серебра с учётом «солевого эффекта», в случае если оно будет больше величины ПР, то концентрация свободных ионов превышает растворимость и осадок не растворится!
Рассчитаем ионную силу раствора хлорида натрия:
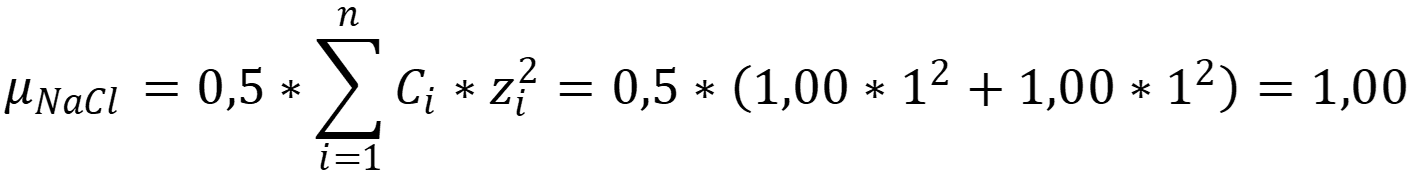
Рассчитаем коэффициенты активностей:
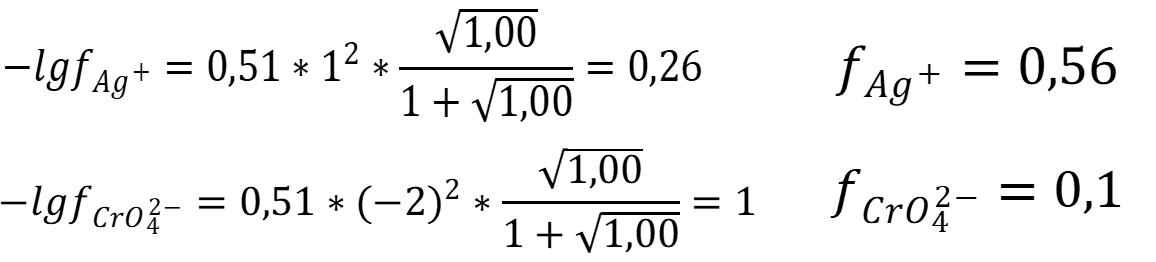
Рассчитаем концентрацию хромата в объёме раствора:
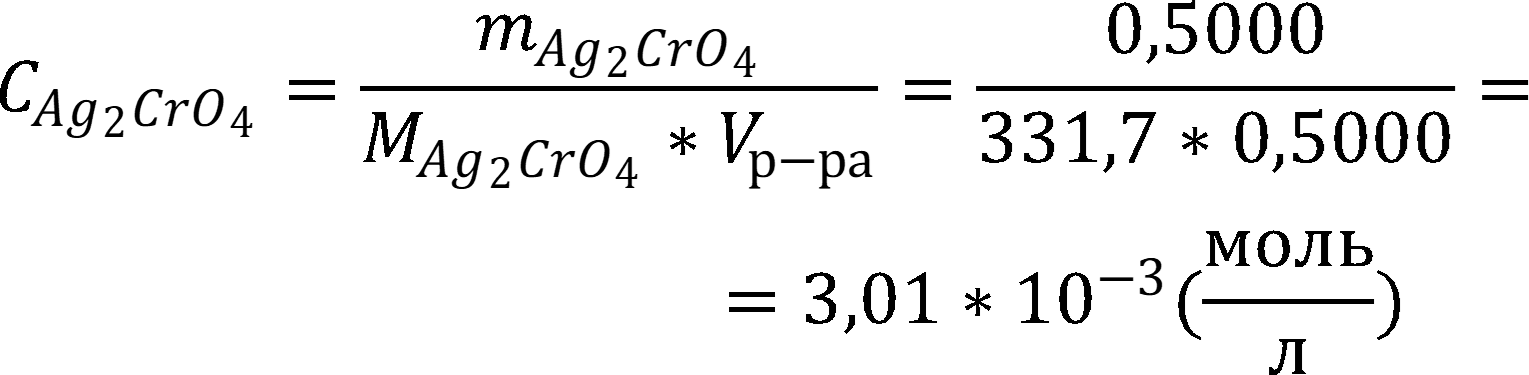
Рассчитаем произведение активностей ионов осадка и сравним с ПР рассчитанным ранее:
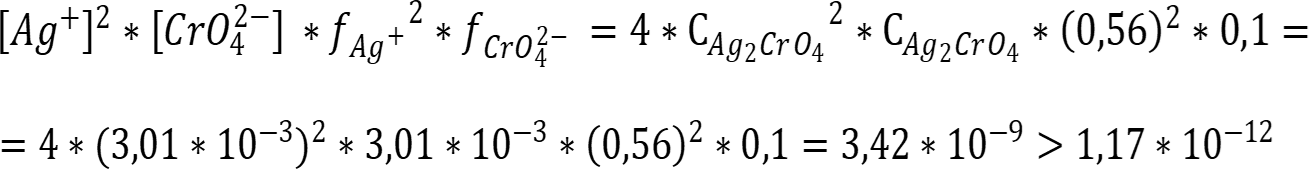
Ответ: ПР = 1,17 * 10-12; Так как рассчитанное произведение активностей больше ПР в данных условиях осадок не растворится. Стоит отметить, что при этом растворимость осадка всё-таки повысится и количество ионов хромата в растворе увеличится!

