Расчёт константы ОВ равновесия
Окислительно-восстановительный (ОВ) процесс - процесс перехода электронов от одной молекулы или иона к другой. Количественной характеристикой ОВ системы является потенциал. Для стандартных условий:
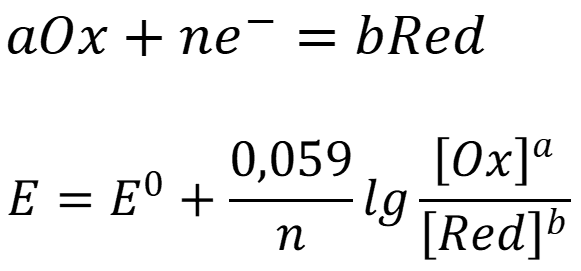
где Е0 – стандартный потенциал системы.
Переход электронов возможен только при разнице потенциалов между ОВ парой. Константа равновесия для процесса равна:
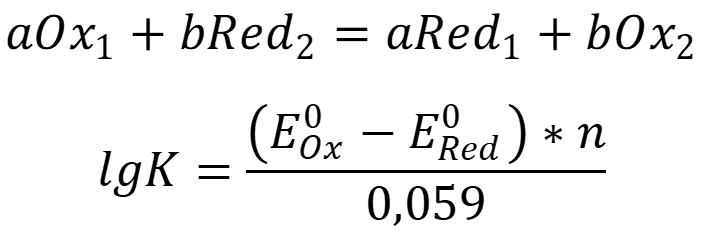
Чем более высокий потенциал системы, тем выше окислительная способность окисленной формы и ниже восстановительная способность восстановленной.
Задача:
Вычислить константу равновесия ОВ реакции:
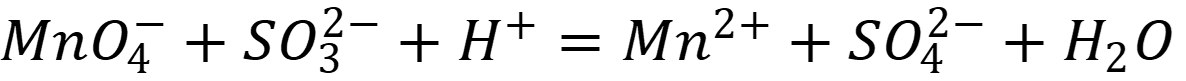
Сделать вывод о её направлении.
Дано:
Уравнение
реакции
ОВ потенциалы систем: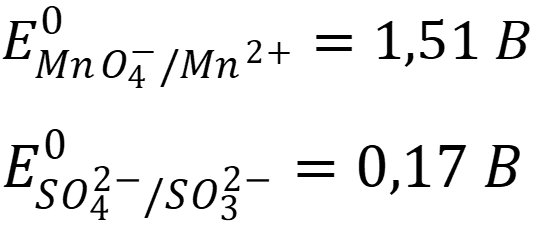
Решение:
Запишем уравнения полуреакций:
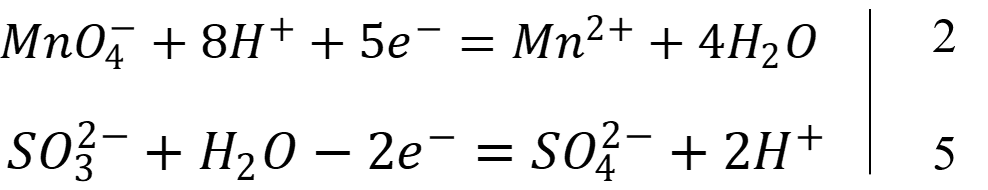
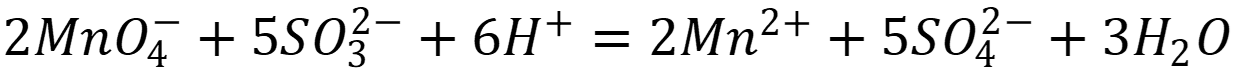
Рассчитаем константу равновесия реакции:
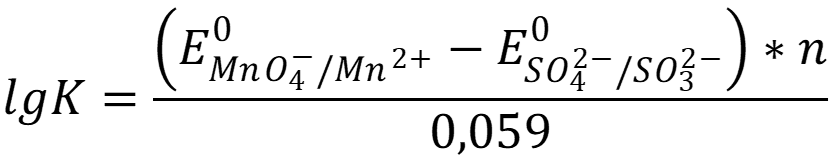
В реакции участвуют n = 10 электронов:
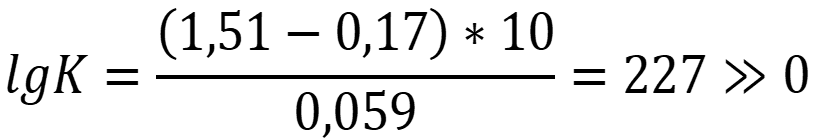
Ответ: Так как константа равновесия много больше нуля, реакция протекает в прямом направлении.

