Кислотно-основное титрование
Титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации:
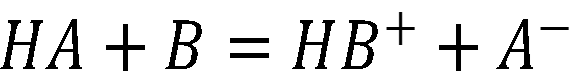
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией. При количественном определении кислот (алкалиметрия) — рабочим раствором является раствор щелочи NaOH или КОН.
Метод пипетирования - титрование равных порций раствора (аликвот), отбираемых пипеткой из мерной колбы определенного объема, в которой растворена навеска анализируемого вещества. Из результатов параллельных титрований находят среднее арифметическое значение и используют для вычисления массы определяемого вещества.
Прямое титрование
При прямом титровании определяемое вещество непосредственно реагирует с титрантом.
Согласно следствию из закона эквивалентов:
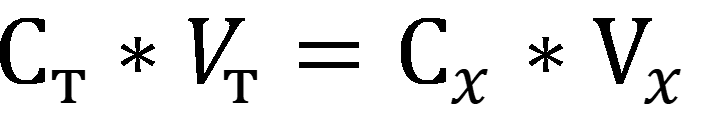
где С – нормальная концентрация вещества.
Задача №1:
Навеску H2C2O4 * 2H2O массой 0,6000 г растворили в мерной колбе на 100,0 мл. На титрование 20,00 мл полученного раствора израсходовали 18,4 мл NaOH. Определить молярную концентрацию щёлочи.
Дано:
mнав
= 0,6000 г
Vр-ра = 100,0 мл
Vал = 20,00
мл
VNaOH = 18,4 мл
СNaOH - ?
Решение:
Рассчитаем концентрацию щавелевой кислоты:
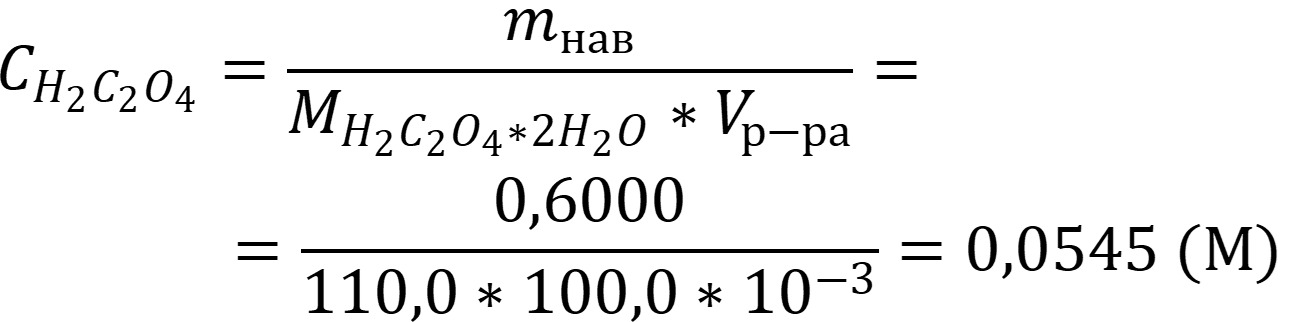
Рассчитаем концентрацию щёлочи по следствию из закона эквивалентов:
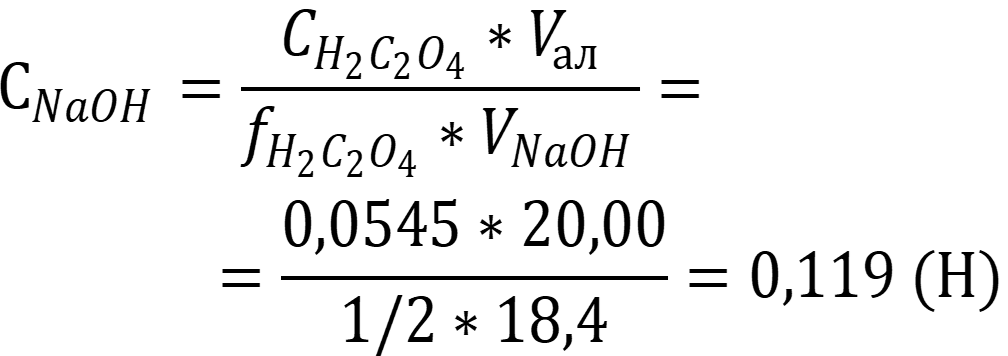
Ответ: CNaOH = 0,119 моль/л.
Обратное титрование
При обратном титровании титрант реагирует с точно известным избытком вспомогательного реагента.
Согласно следствию из закона эквивалентов:

Задача №2:
К раствору фосфата калия объёмом 100,0 мл прибавили 25,00 мл 0,2000 М серной кислоты. На титрование избытка серной кислоты израсходовали 15,00 мл едкого натра концентрацией 0,09898 М. Определить концентрацию фосфата калия.
Дано:
Vр-ра
= 100,0 мл
Vк-ты = 25,00 мл
Ск-ты = 0,2000
М
VNaOH = 15,0 мл
СNaOH = 0,09898
Н
Сфосфата - ?
Решение:
Рассчитаем нормальную концентрацию кислоты:
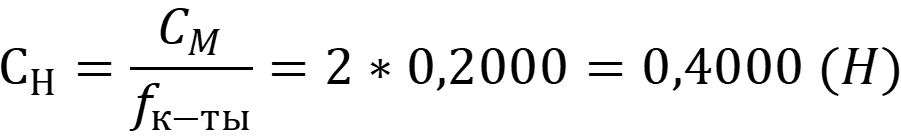
По закону эквивалентов:
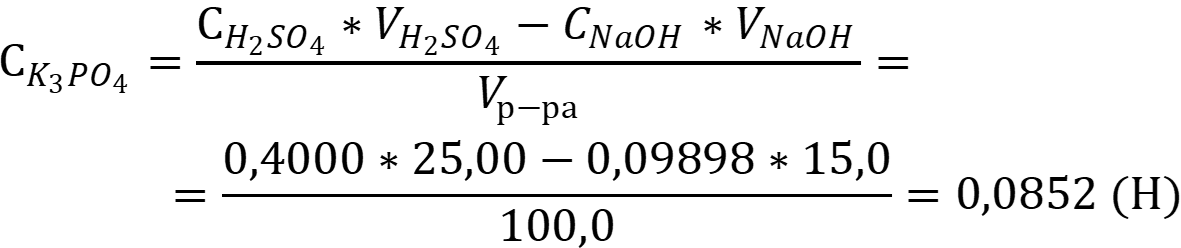
Ответ: Cфосфата = 0,0852 Н.
Заместительное титрование
При заместительном титровании титруют продукт реакции исходного вещества и реагента.
Согласно следствию из закона эквивалентов:

где С – нормальная концентрация вещества.
Задача №3:
После сжигания навески колчедана массой 0,1400 г выделившийся газ поглотили 100,0 мл раствора перекиси водорода. На титрование 20,00 мл получившейся серной кислоты с феноловым красным израсходовали 24,9 мл 0,0950 М NaOH. Вычислить массовую долю серы в колчедане.
Дано:
mнав
= 0,1400 г
Vр-ра = 100,0 мл
Vал= 20,00
мл
СNaOH = 0,0950 М
VNaOH = 9,2 мл
ωS
- ?
Решение:
Согласно закону эквивалентов количество серы в колчедане эквивалентно количеству кислоты:

Массовая доля серы равна:
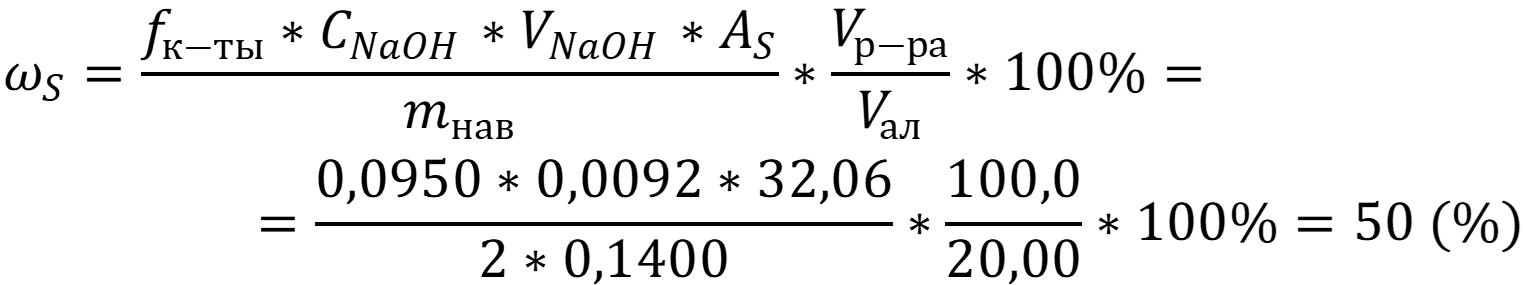
Ответ: ωS = 50 %.

