Комплексонометрия
Метод основан на титровании раствором комплексона III (ЭДТА) растворов солей в присутствии металлоиндикаторов, образующих с ионами металла интенсивно окрашенные соединения. Вблизи точки эквивалентности происходит изменение окраски раствора.
Метод пипетирования - титрование равных порций раствора (аликвот), отбираемых пипеткой из мерной колбы определенного объема, в которой растворена навеска анализируемого вещества. Из результатов параллельных титрований находят среднее арифметическое значение и используют для вычисления массы определяемого вещества.
Прямое титрование
При прямом титровании определяемое вещество непосредственно реагирует с титрантом. Согласно следствию из закона эквивалентов:
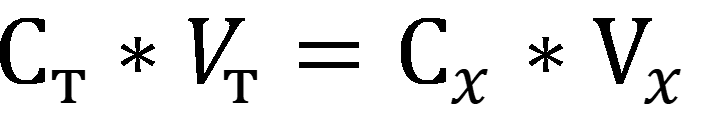
где С – нормальная концентрация вещества.
Задача №1:
На титрование 20,00 мл раствора хлорида никеля II израсходовано 21,2 мл 0,02065 М раствора ЭДТА. Определить массу соли никеля в растворе.
Дано:
СЭДТА
= 0,02065 М
Vр-ра = 20,00 мл
VЭДТА = 21,2
мл
mхлорида - ?
Решение:
Рассчитаем концентрацию хлорида никеля II в растворе по следствию из закона эквивалентов:
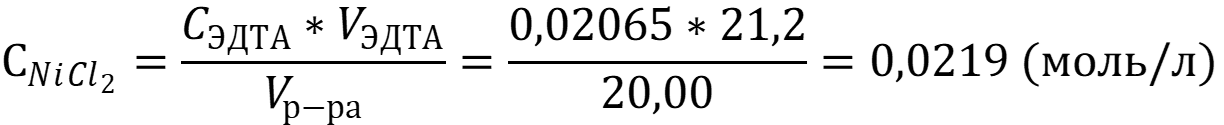
Рассчитаем массу хлорида никеля II в растворе :
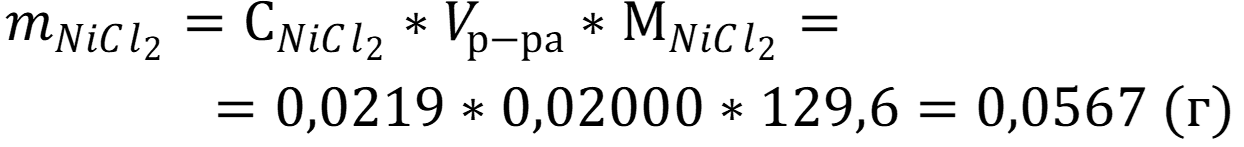
Ответ: mNaCl = 0,0567 г
Обратное титрование
При обратном титровании титрант реагирует с точно известным избытком вспомогательного реагента. Согласно следствию из закона эквивалентов:
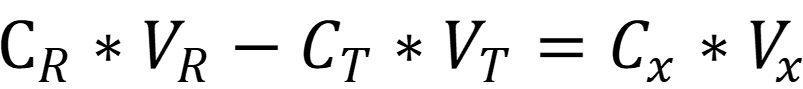
Задача №2:
К 10,00 мл раствора хлорида никеля II добавили дистиллированную воду, аммиачный буферный раствор и 20,00 мл 0,01085 М раствора ЭДТА. Избыток оттитровали 0,01292 М раствором хлорида магния, на титрование ушло 5,47 мл. Рассчитать массу хлорида никеля в растворе.
Дано:
Vр-ра
= 10,00 мл
VЭДТА = 20,00 мл
СЭДТА = 0,01085
моль/л
СMgCl2 = 0,01292
моль/л
VMgCl2 = 5,47 мл
mхлорида -
?
Решение:
Согласно следствию из закона эквивалентов концентрация хлорида никеля II равна:
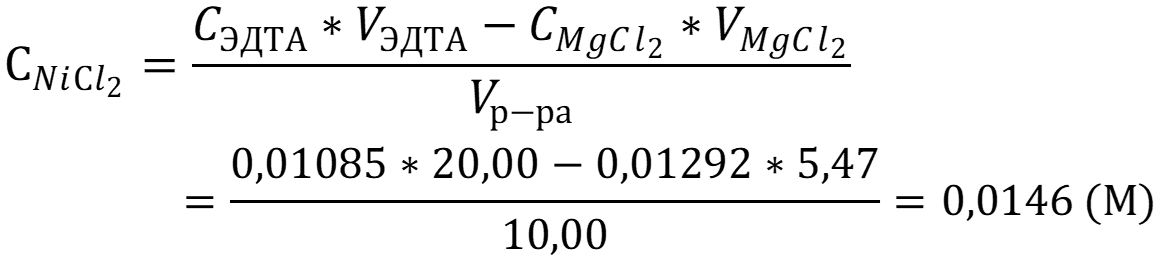
Рассчитаем массу хлорида никеля II в растворе:
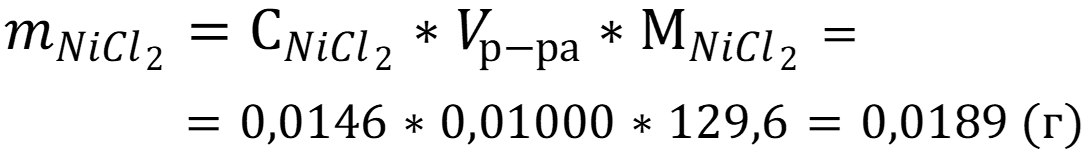
Ответ: mхлорида = 0,0189 г.
Заместительное титрование
При заместительном титровании титруют продукт реакции исходного вещества и реагента. Согласно следствию из закона эквивалентов:
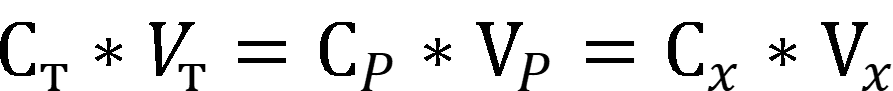
где С – нормальная концентрация вещества.
Задача №3:
На титрование 20,00 мл раствора нитрата ртути II после добавления избытка Na2MgЭДТА и протекания реакции:
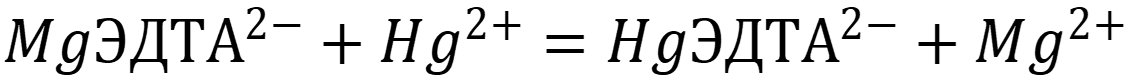
Затрачено 19,9 мл 0,0500 М раствора ЭДТА. Вычислить концентрацию раствора нитрата ртути II.
Дано:
Vнитрата
= 20,00 мл
СЭДТА = 0,0500 моль/л
VЭДТА = 19,9
мл
Снитрата - ?
Решение:
Согласно следствию из закона эквивалентов:
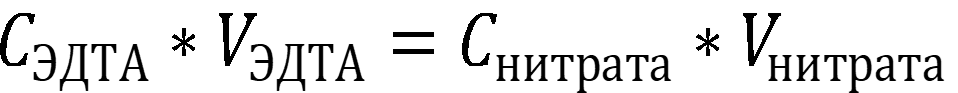
где V – в литрах, С – молярная концентрация.
Концентрация нитрата ртути II равна:
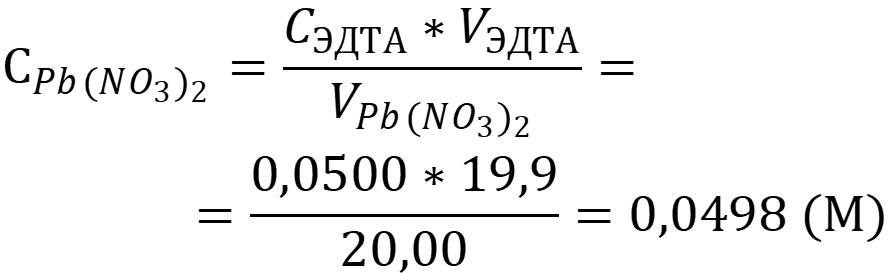
Ответ: Снитрата = 0,0498 М.

