Кислотно-основное титрование
Титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации:
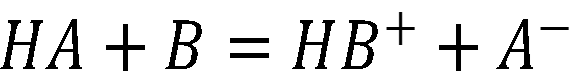
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией. При количественном определении кислот (алкалиметрия) — рабочим раствором является раствор щелочи NaOH или КОН.
Метод отдельных навесок заключается в том, что определенное число навесок вещества взвешивают на аналитических весах, растворяют в небольшом объеме растворителя и проводят их титрование. Метод более точен чем метод пипетирования!
Прямое титрование
При прямом титровании определяемое вещество непосредственно реагирует с титрантом. Согласно следствию из закона эквивалентов:
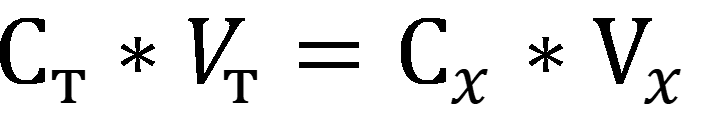
где С – нормальная концентрация вещества.
Задача №1:
По методике анализа титрантом является раствор гидроксида натрия с концентрацией СNаОН = 0,1000 моль/л. При стандартизации приготовленного раствора гидроксида натрия на титрование навески дигидрата щавелевой кислоты массой 0,1366 г затрачено 22,1 мл раствора NаОН. Вычислите поправочный коэффициент титранта К.
Дано:
СNаОН = 0,1000 моль/л
mН2С2О4
∙ 2Н2O = 0,1366 г
VNаОН = 22,1 мл
K -
?
Решение:
Поскольку для щавелевой кислоты рКа2 – рКа1 = 4,23 – 1,25 < 4, титрование ее щелочью проходит в одну стадию по уравнению:
NaOH + H2C2O4 = Na2C2O4 + 2H2O
Рассчитаем реальную концентрацию щёлочи:
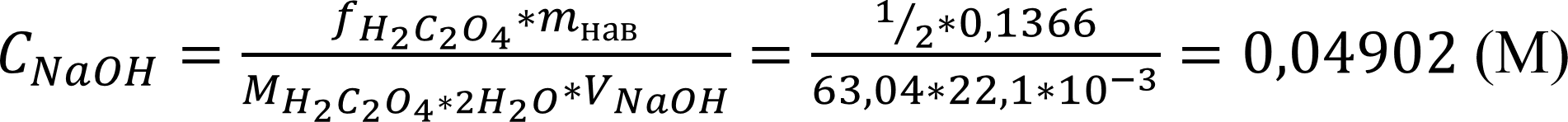
Рассчитаем поправочный коэффициент:
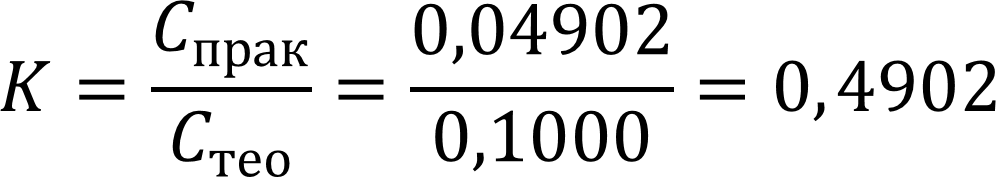
Ответ: К = 0,4902.
Обратное титрование
При обратном титровании титрант реагирует с точно известным избытком вспомогательного реагента. Согласно следствию из закона эквивалентов:

Задача №2:
Для определения содержания формальдегида в пробе навеску препарата массой 3,0170 г обработали 50,00 мл 1,000 М раствора NaOH (К = 0,9022) в присутствии пероксида водорода. При нагревании произошла реакция:
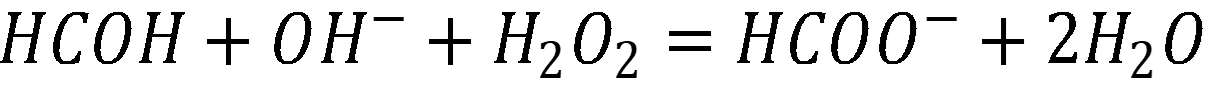
По охлаждении избыток щелочи оттитровали 20,1 мл раствора НСl с C = 1,042 M. Вычислить массовую долю (в %) формальдегида в пробе.
Дано:
mнав
= 3,0170 г
Vк-ты = 20,1 мл
Ск-ты = 1,042
М
VNaOH = 50,00 мл
СNaOH = 1,000 М
К =
0,9022
ωформ - ?
Решение:
Определение проведено по способу обратного титрования, методу отдельных навесок. Расчет результата проводят по формуле:
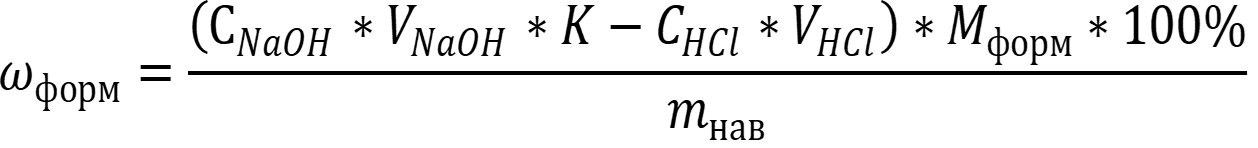
Рассчитаем массовую долю формальдегида в образце:
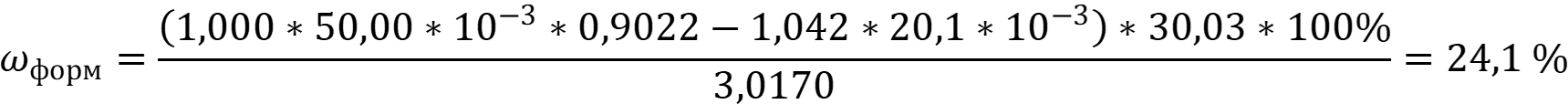
Ответ: ωформ = 24,1 %.
Заместительное титрование
При заместительном титровании титруют продукт реакции исходного вещества и реагента. Согласно следствию из закона эквивалентов:

где С – нормальная концентрация вещества.
Задача №3:
Для определения бензальдегида навеску массой 0,4728 г обработали раствором солянокислого гидроксиламина:
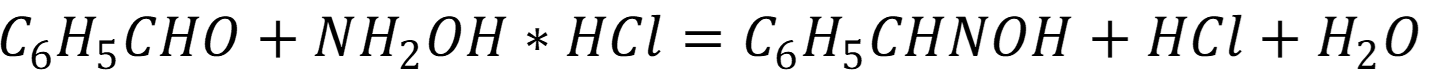
и выделившуюся хлороводородную кислоту оттитровали 19,45 мл 0,2500 М NaOH (К = 0,9845). На титрование солянокислого гидроксиламина в холостом опыте израсходовали 1,75 мл того же раствора NaOH. Вычислить массовую долю (в %) бензальдегида в исходном продукте.
Дано:
mнав
= 0,4728 г
СNaOH = 0,2500 М
K = 0,9845
VNaOH =
19,5 мл
Vхол = 1,75 мл
ωбенз. - ?
Решение:
При титровании по способу замещения расчетная формула имеет вид:
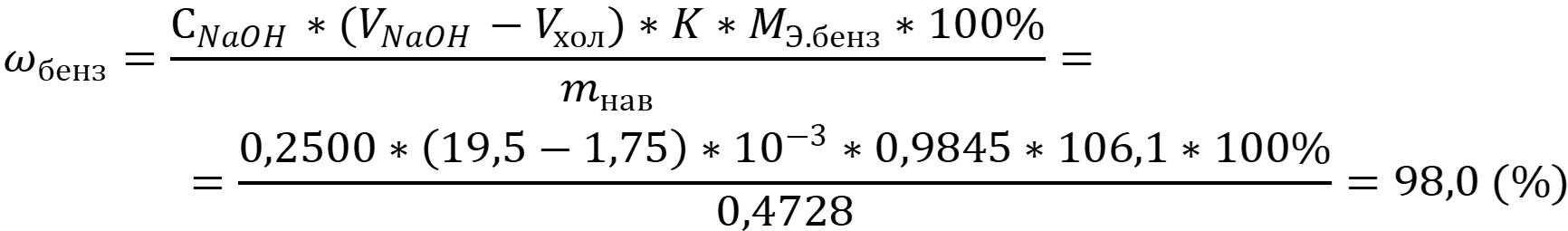
Ответ: ωбенз = 98,0 %.

