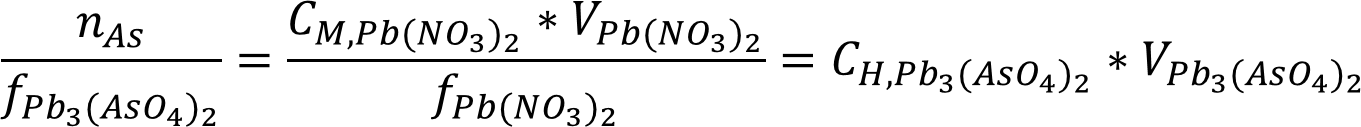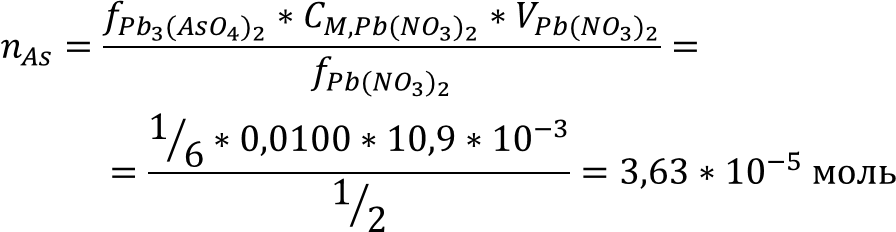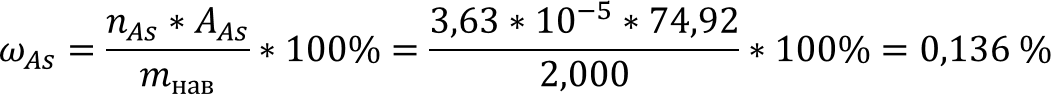Осадительное титрование
Метод основан на образовании осадка в близи точки эквивалентности. По способу индикации осадка выделяют:
- Метод Мора – образование осадка кирпично – красного осадка хромата серебра
- Метод Фольгарда – обратное титрование галогенид ионов в присутствии ионов железа III. Титрант – тиоцианат калия, реагент - нитрат серебра
- Метод Фаянса – использование адсорбционных индикаторов – соединений меняющих цвет при адсобции
Метод отдельных навесок заключается в том, что определенное число навесок вещества взвешивают на аналитических весах, растворяют в небольшом объеме растворителя и проводят их титрование. Метод более точен чем метод пипетирования!
Прямое титрование
При прямом титровании определяемое вещество непосредственно реагирует с титрантом. Согласно следствию из закона эквивалентов:
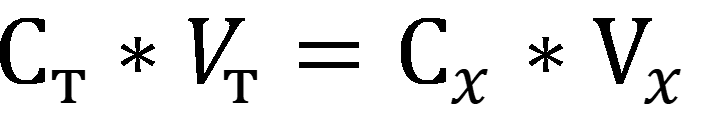
где С – нормальная концентрация вещества.
Задача №1:
Рассчитайте молярную концентрацию Нg2(NО3)2, если на титрование 0,1050 г NаС1 прошло 20,0 мл раствора Нg2(NО3)2.
Дано:
mNaCl
= 0,1050 г
Vт = 20,0 мл
Ст - ?
Решение:
Реакция проходит по уравнению:
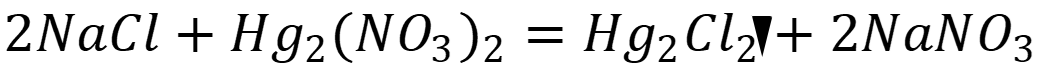
Рассчитаем концентрацию хлорида натрия по формуле для прямого титрования:
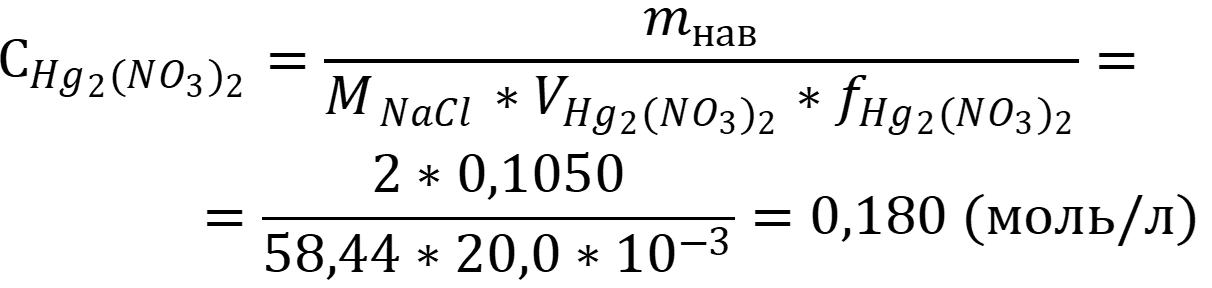
Ответ: Снитрата = 0,180 М.
Обратное титрование
При обратном титровании титрант реагирует с точно известным избытком вспомогательного реагента. Согласно следствию из закона эквивалентов:

Задача №2:
К навеске хлоридов массой 0,2266 г прибавлено 25,00 мл 0,1121 н. раствора АgNО3. Избыток раствора нитрата серебра оттитровали 6,50 мл 0,1158 н. NН4СNS. Рассчитайте массовую долю хлора в анализируемом веществе.
Дано:
mнав
= 0,2266 г
Vнитрата = 25,00 мл
Снитрата = 0,1121
Н
СKSCN = 0,1158 Н
VKSCN = 6,50 мл
ωCl
- ?
Решение:
Согласно закону эквивалентов массовая доля хлорид - ионов равна:
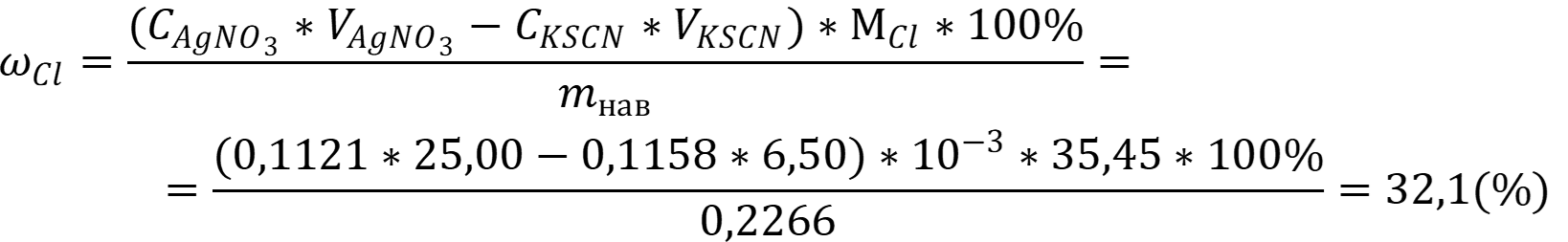
Ответ: ωCl = 32,1 %.
Заместительное титрование
При заместительном титровании титруют продукт реакции исходного вещества и реагента. Согласно следствию из закона эквивалентов:

где С – нормальная концентрация вещества.
Задача №3:
Продукты
сгорания органического вещества вместе с содержащимся в нём в качестве примеси
мышьяком массой 2,000 г были поглощены 20,00 мл щелочного раствора перекиси
водорода. Образовавшийся арсенат был оттитрован 10,9 мл 0,0100 М раствора
нитрата свинца в присутствии адсорбционного индикатора пиридилазорезорцина.
Вычислить массовую долю мышьяка в образце, если в результате титрования
образуется Pb3(AsO4)2
Дано: mнав
= 2,000 г Решение: Согласно
закону эквивалентов количество мышьяка в органическом
веществе эквивалентно количеству нитрата и образовавшегося арсената,
обратим внимание на то, что концентрация нитрата
- молярная: где
f – фактор эквивалентности, V – объём в литрах, С – нормальная
концентрация. Выразим
количество мышьяка из первых двух членов равенства: Массовая
доля мышьяка равна: Ответ: ωAs = 0,136
%.
Vр-ра = 20,00 мл
Снитрата = 0,0100
моль/л
Vнитрата = 10,9 мл
ωАs - ?