Комплексонометрия
Метод основан на титровании раствором комплексона III (ЭДТА) растворов солей в присутствии металлоиндикаторов образующих с ионами металла интенсивно окрашенные соединения. Вблизи точки эквивалентности происходит изменение окраски раствора.
Метод отдельных навесок заключается в том, что определенное число навесок вещества взвешивают на аналитических весах, растворяют в небольшом объеме растворителя и проводят их титрование. Метод более точен чем метод пипетирования!
Прямое титрование
При прямом титровании определяемое вещество непосредственно реагирует с титрантом. Согласно следствию из закона эквивалентов:
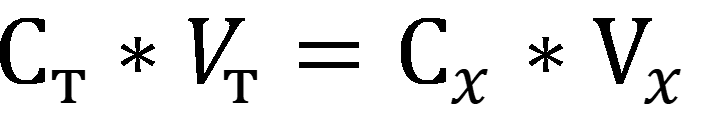
где С – нормальная концентрация вещества.
Задача №1:
На титрование 0,1035 г CaCO3 израсходовали 20,2 мл раствора ЭДТА. Рассчитать молярную концентрацию ЭДТА.
Дано:
mCaCO3
= 0,1035 г
VЭДТА = 20,2 мл
СЭДТА - ?
Решение:
Концентрация ЭДТА рассчитывается по формулам для прямого титрования:
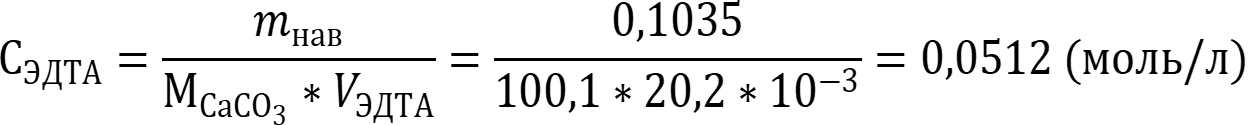
Ответ: СЭДТА = 0,0512 моль/л
Обратное титрование
При обратном титровании титрант реагирует с точно известным избытком вспомогательного реагента. Согласно следствию из закона эквивалентов:

Задача №2:
К подкисленному раствору, полученному растворением навески образца массой 0,5051 г, содержащего основной карбонат висмута, добавили избыток 0,0500 М раствора ЭДТА, равный 20,00 мл. После доведения рН до 9,30 избыток ЭДТА оттитровали 0,0500 М ZnSO4 в присутствии эриохрома черного Т. Рассчитайте массовую долю висмута (%), если на титрование ЭДТА израсходовано 9,20 мл ZnSO4.
Дано:
mнав
= 0,5051 г
VЭДТА = 20,00 мл
СЭДТА = 0,0500
моль/л
СZnSO4 = 0,0500
моль/л
VZnSO4 = 9,20 мл
ωBi -
?
Решение:
Расчёт проводится по формулам для обратного титрования:
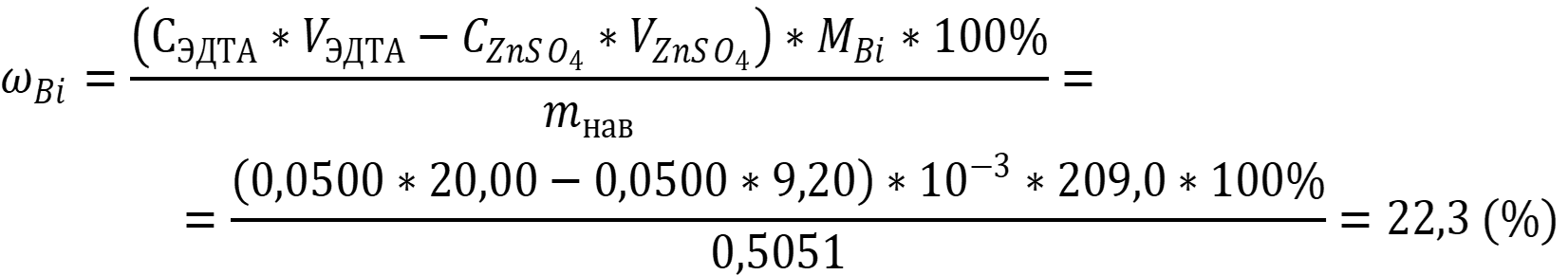
Ответ: ωBi = 22,3 %.
Заместительное титрование
При заместительном титровании титруют продукт реакции исходного вещества и реагента. Согласно следствию из закона эквивалентов:

где С – нормальная концентрация вещества.
Задача №3:
Ионы серебра, содержавшиеся в 0,5001 г пробы, после растворения и предварительной подготовки связали в цианидный комплекс, добавив избыток раствора [Ni(CN)4]2-. На титрование выделившихся ионов никеля израсходовали 43,7 мл 0,0240 М раствора ЭДТА. Рассчитайте массовую долю серебра в пробе.
Дано:
mсплава
= 0,5001 г
СЭДТА = 0,0240 моль/л
VЭДТА = 43,7
мл
ωAg - ?
Решение:
Массовую долю серебра находим по формуле для заместительного титрования:
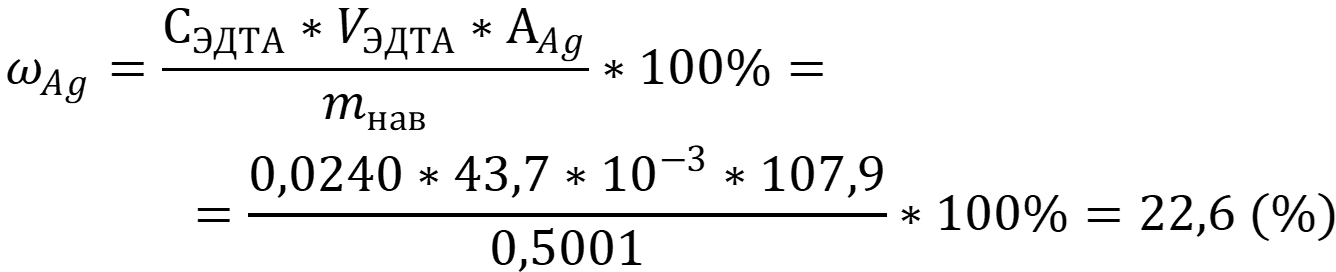
Ответ: ωAg = 22,6 %.

