Окислительно-восстановительное титрование
Метод основан на применении окислительно-восстановительных реакций с применением индикаторов:
- Реагирующих на присутствие компонентов системы
- Изменяющих окраску при определённом потенциале ОВ системы
Так же возможны без индикаторные способы при наличии окраски у титранта или определяемого вещества.
Метод отдельных навесок заключается в том, что определенное число навесок вещества взвешивают на аналитических весах, растворяют в небольшом объеме растворителя и проводят их титрование. Метод более точен чем метод пипетирования!
Прямое титрование
При прямом титровании определяемое вещество непосредственно реагирует с титрантом. Согласно следствию из закона эквивалентов:
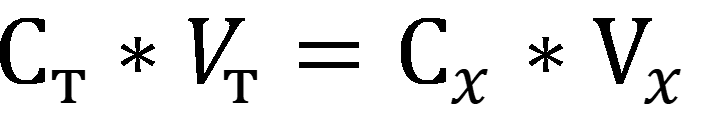
где С – нормальная концентрация вещества.
Задача №1:
Навеску химически чистого кристаллогидрата оксалата аммония (NH4)2C2O4 * H2O массой 0,3200 г растворили в произвольном объеме воды, оттитровали раствором перманганата калия KMnO4, затратив 10,3 мл. Рассчитать молярную концентрацию эквивалента перманганата калия.
Дано:
mнав
= 0,3200 г
Vт = 10,3 мл
Ст - ?
Решение:
Согласно закону эквивалентов нормальная концентрация перманганата равна:
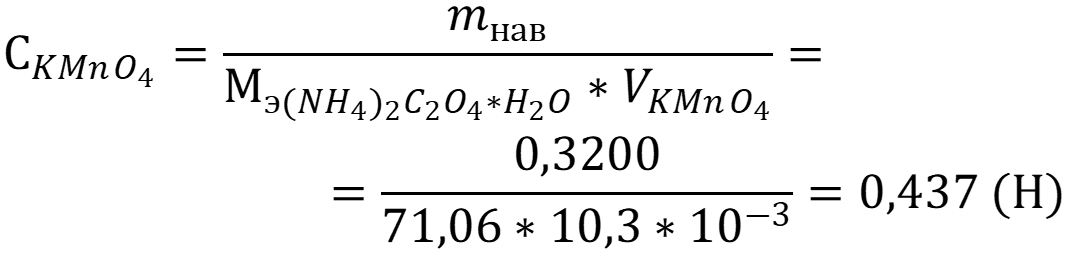
Ответ: Сперманганата = 0,437 Н.
Обратное титрование
При обратном титровании титрант реагирует с точно известным избытком вспомогательного реагента. Согласно следствию из закона эквивалентов:

Задача №2:
К раствору содержащему 0,1510 г технического хлората калия прилили 100,0 мл 0,09852 н. раствора оксалата натрия, избыток которого оттитровали 22,6 мл 0,1146 н. раствора перманганата калия. Вычислить массовую долю хлората калия в образце.
Дано:
mнав
= 0,1510 г
Vоксалата = 100,0 мл
Соксалата = 0,09852
Н
VМnO4- = 22,6
мл
СMnO4- = 0,1146 H
ωхлората
- ?
Решение:
Согласно закону эквивалентов количество хлората в навеске:
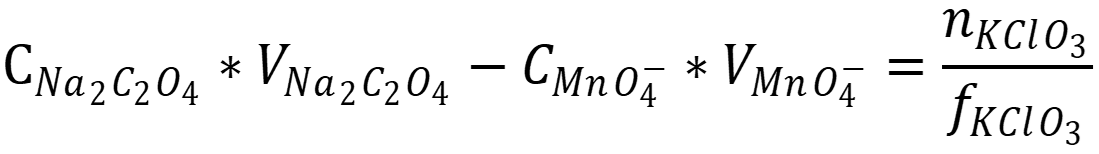
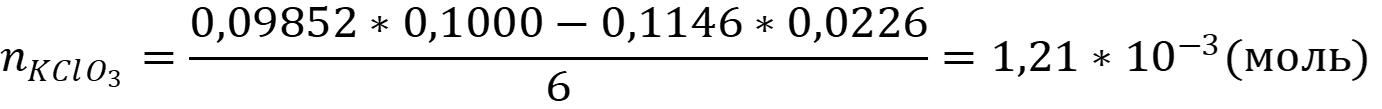
Рассчитаем массовую хлората в образце:
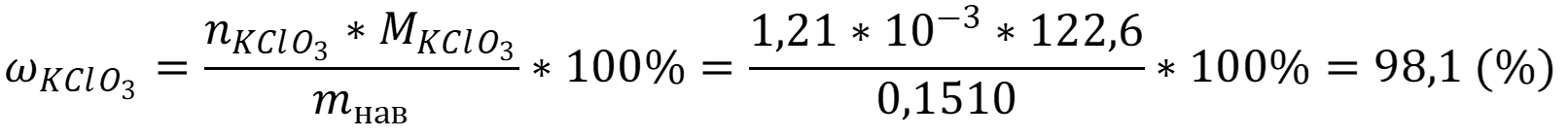
Ответ: ωхлората = 98,1 %.
Заместительное титрование
При заместительном титровании титруют продукт реакции исходного вещества и реагента. Согласно следствию из закона эквивалентов:

где С – нормальная концентрация вещества.
Задача №3:
Навеску технического CuCl массой 0,2600 г растворили в избытке солянокислого раствора NH4Fe(SO4)2. На титрование образовавшихся ионов железа II израсходовали 20,18 мл 0,1200 н раствора бихромата калия. Рассчитать массовую долю СuCl в образце.
Дано:
mнав
= 0,2600 г
Сбх = 0,1200 н
Vбх = 21,8
мл
ωСuCl - ?
Решение:
Согласно закону эквивалентов количество хлорида меди I:
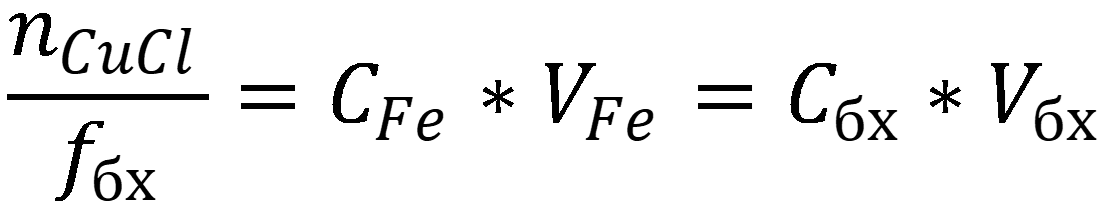
где f – фактор эквивалентности, V – объём в литрах, С – нормальная концентрация.
Массовая доля хлорида меди I равна:
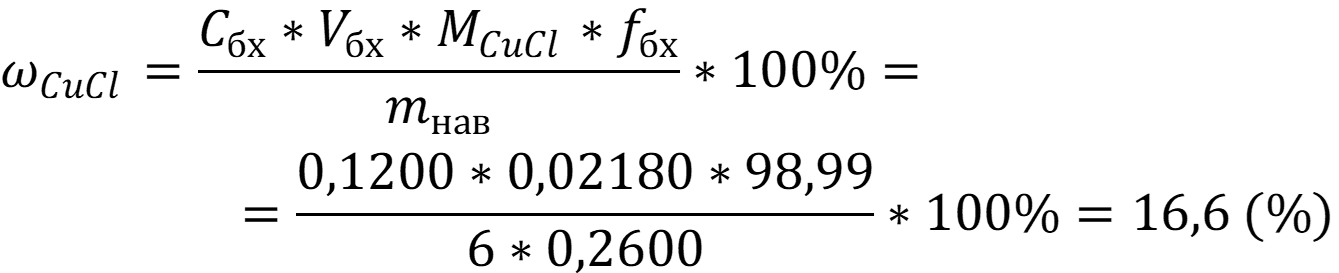
Ответ: ωCuCl = 16,6 %.

