Потенциометрическое титрование
Метод основан на резком изменении свойств системы вблизи точки эквивалентности при титровании. Кривые титрования могут иметь различный вид в зависимости от координат, в которых они построены.

Задача:
Анализируемый раствор HCl разбавили в мерной колбе до 100,0 мл и аликвоту объёмом 20,00 мл оттитровали потенциометрически 0,1000 М раствором NaOH. Определить массу НСl в растворе по следующим данным:
|
Vт, мл |
1,50 |
1,80 |
1,90 |
1,95 |
1,98 |
2,00 |
2,02 |
2,05 |
2,10 |
|
pH |
2,64 |
3,05 |
3,36 |
3,64 |
4,05 |
6,98 |
9,95 |
10,53 |
10,65 |
Дано:
Vисх
= 100,0 мл
Vалик. = 20,00 мл
Ст = 0,1000
М
Зависимость pH от объёма титранта
mHCl - ?
Решение:
В данном примере происходит титрование сильной кислоты сильным основанием, что должно обеспечить чёткий скачок на кривой. Строим интегральную или дифференциальную кривую для определения точки эквивалентности.
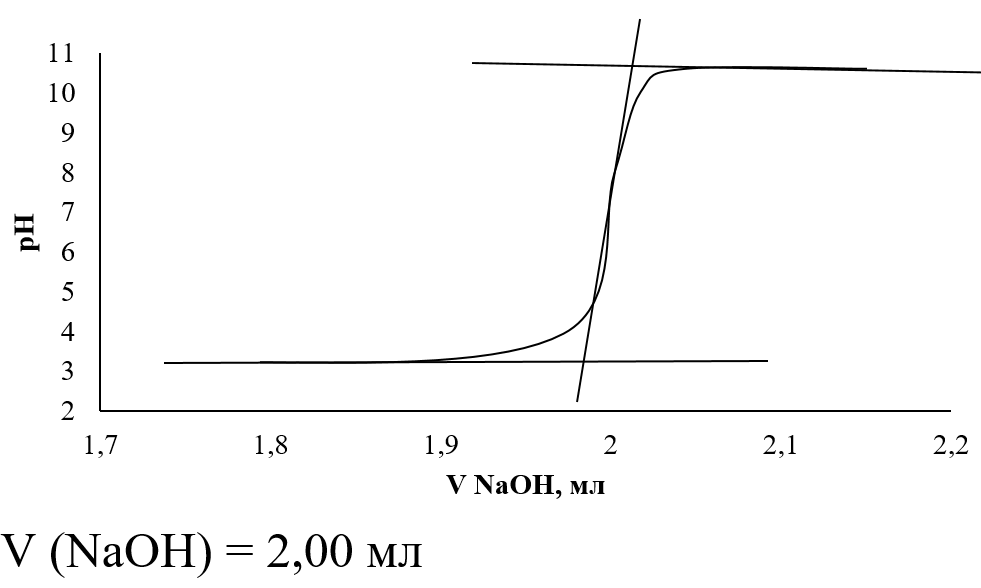
Определение точки эквивалентности по интегральной кривой
Используем метод трёх касательных
Определение точки эквивалентности по дифференциальной кривой первого порядка
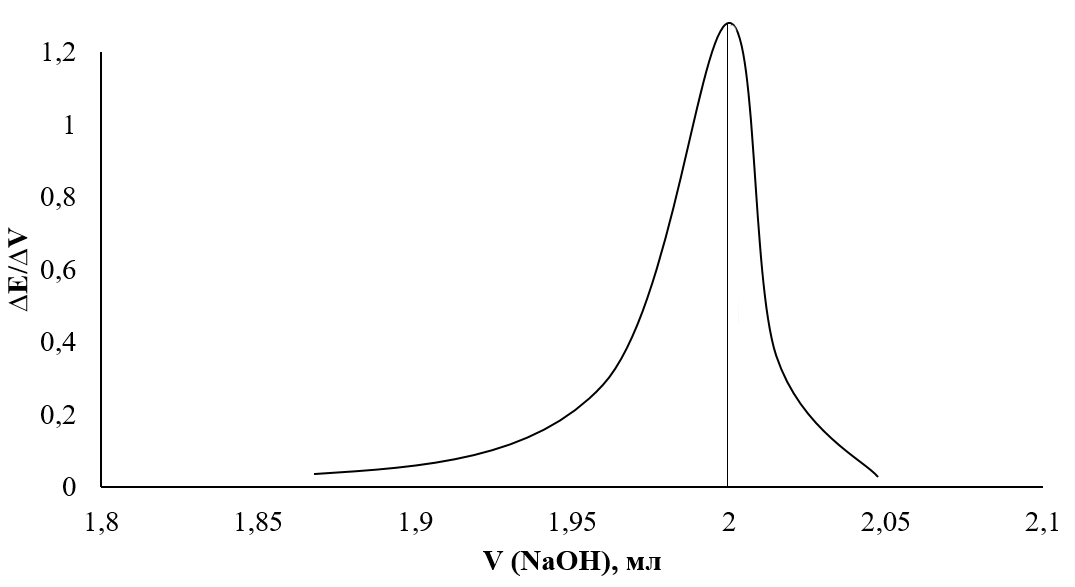
VNaOH = 1,99 мл.
Далее рассчитываем массу по стандартным формулам для прямого титрования используя ТЭ определённую по дифференциальной кривой первого порядка:
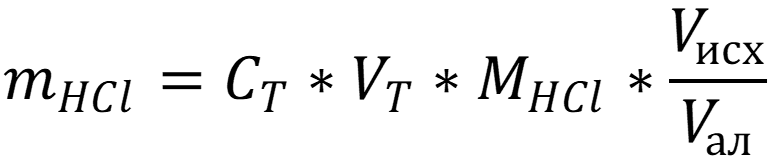
Вычисляем массу HCl в исходном растворе:
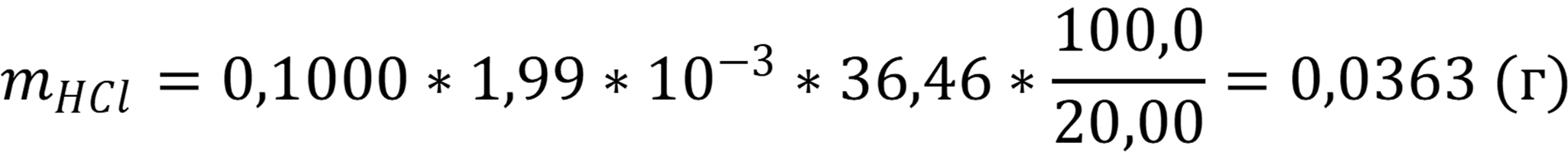
В условиях данной задачи объёмы аликвоты и исходного раствора - избыточные данные!!!
Ответ: mHCl = 0,0363 г - при реакции сильных электролитов скачки достаточно сильные и достаточно интегральной или дифференциальной кривых. Но расчёт дифференциальной кривой достаточно сложен и используется при расчётах повышенной точности.
Рассмотрим случай использования второй производной и метода Грана.

